题目内容
【题目】某固体混合物由Mg和MgO组成,取该混合物6.4g与19.6%的稀硫酸恰好完全反应,所得溶液蒸发82.2g水后得到固体的质量为24g,则原混合物中氧元素的质量分数为()
A.25%
B.20%
C.16%
D.40%
【答案】A
【解析】
根据化学反应原理知所得溶液的溶质为MgSO4,根据元素守恒定律知硫酸镁中镁元素的质量即为原固体混合物中镁元素的质量,混合物的质量减去镁元素的质量即为氧元素的质量。
镁粉、氧化镁与硫酸反应的化学方程式为Mg+H2SO4=MgSO4+H2↑、MgO+H2SO4=MgSO4+H2O;由此可推出所得24g为硫酸镁的质量。
硫酸镁中镁元素的质量为24g×![]() ×100%=4.8g;硫酸镁中镁元素的质量即为混合物中镁元素的质量。
×100%=4.8g;硫酸镁中镁元素的质量即为混合物中镁元素的质量。
混合物中氧元素的质量即为:6.4g-4.8g=1.6g,
原混合物中氧元素的质量分数为:![]() ×100%=25%;
×100%=25%;
故选:A。

 名校练考卷期末冲刺卷系列答案
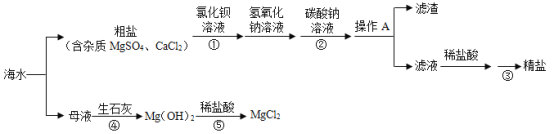
名校练考卷期末冲刺卷系列答案【题目】某实验小组在探究碱的化学性质实验时,用到了氢氧化钠溶液和氢氧化钙溶液。
(1)甲同学不小心将这两种溶液混合在一起,结果产生_______的现象,说明氢氧化钠溶液变质了。写出变质时发生反应的化学方程式_______。
(2)同学们对变质的氢氧化钠溶液中溶质的成分产生了兴趣,进行如下探究:
[提出问题]氢氧化钠溶液中溶质的成分是什么?
[做出猜想]猜想一: Na2CO3
猜想二: ______(写化学式)
[进行讨论]甲同学取少量待测液加入足量的稀盐酸,有气泡产生。认为猜想一成立。乙同学不同意甲同学的观点,理由是_______。
[设计实验]请你验证猜想二成立,并完成实验报告。
实验操作 | 实验现象 | 实验结论 |
①取一定量的待测液于试管中,加入______溶液。 ②充分反应后静置,取上层清液加入无色酚酞溶液 | ①_______ ②_______ | 猜想二成立 |
[反思评价]在实验室中,氢氧化钠应_________保存。
【题目】现有一家庭食用纯碱样品,其中含杂质氯化钠(不含其他杂质),为了测定样品中杂质氯化钠的质量分数,李明同学进行了三次实验。实验数据如下表:
编号 | 第1次 | 第2次 | 第3次 |
所取固体样品的质量g | 15 | 12 | 12 |
加入氯化钙溶液的质量/g | 100 | 100 | 150 |
反应后生成沉淀的质量/g | 10 | 10 | 10 |
完成下列计算(计算结果精确到0.1%):
(1)第_______次实验是恰好完全反应。
(2)加入氯化钙溶液的溶质质量分数。______
(3)样品中氯化钠的质量分数。_______