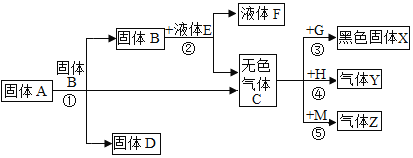
题目内容
【题目】下列实验操作正确的是
A.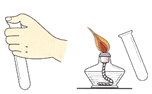 氢气的验纯B.
氢气的验纯B.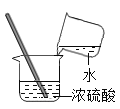 稀释浓硫酸
稀释浓硫酸
C.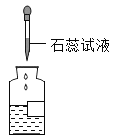 测稀盐酸的酸碱性D.
测稀盐酸的酸碱性D.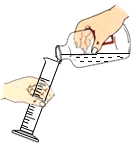 量取液体的体积
量取液体的体积
【答案】D
【解析】
A、检验氢气纯度的方法:用排水法收集一试管氢气,用拇指堵住试管口,管口向下移近酒精灯火焰,松开拇指点火,如果听到尖锐的爆鸣声,表明氢气不纯,需要再收集,再检验,直到听到很小的响声,才表明氢气已经纯净,图中所示操作错误。
B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中;图中所示操作错误。
C、测定稀盐酸的酸碱性,应取样滴加石蕊溶液,不能直接向试剂瓶中滴加石蕊溶液,图中所示操作错误。
D、向量筒中倾倒液体药品时,量筒要倾斜,标签要对准手心,瓶口紧挨,图中所示操作正确。
故选:D。

 名校课堂系列答案
名校课堂系列答案【题目】小红、小军、小明三人化学学习小组在实验中,用到了三个分别盛有KCl溶液、KOH溶液、K2SO4溶液的滴瓶。
小军发现小红将三个滴瓶中的三只滴管混用,认为小红实验不规范,滴瓶中的试剂会因此受污染而无法再次使用,学习小组就盛有KCl溶液的滴瓶是否被另外两种试剂污染进行了如下探究。
(提出问题)该滴瓶中溶质的成分是什么?
(提出猜想)通过分析,提出如下猜想:
猜想Ⅰ:溶质成分只有KCl;
猜想Ⅱ:溶质成分为KCl和KOH;
猜想Ⅲ:溶质成分为_____;
猜想Ⅳ:溶质成分为KCl、KOH和K2SO4。
(实验探究)为证明猜想,小军设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 结论或解释 |
(1)取该滴瓶内溶液少量于试管中,向试管中加入适量BaCl2溶液 | 产生白色沉淀 | 该反应的化学方程式为 _____ |
(2)将上述反应后的混合液过滤,取滤液于另一支试管中,向该试管中加入氯化铁溶液 | _____ | 证明猜想Ⅳ成立 |
(实验反思)小明认为该实验方案并未证明猜想Ⅱ、Ⅲ是否成立,应补充相应实验予以证明,你是否赞同?_____(填“是”或“否”)。
【题目】(题文)某校兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:
①取5只250mL 集气瓶,向 5 只集气瓶中分别装入 25mL、50mL、75mL、100mL、125mL 的 水,并用毛玻璃片盖住,依次编号为 1、2、3、4、5;
②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述 15 号瓶中的水 排去;③将带火星的木条依次插入 15 号瓶中,把观察到现象和计算数据,填入下表。

试回答下列问题:
(1)集气瓶2中氧气的体积分数为_____.(空气中氧气的体积分数以 21%计)
(2)根据以上实验事实,下列说法中正确的是_____(填写相应的字母).
A. 只有在纯氧中才能使带火星的木条复燃
B. 集气瓶中氧气的体积分数52.6%时,带火星的木条就能复燃
C. 只要有氧气存在就可使带火星的木条复燃。
(3)以上实验表明,使用带火星的小木条验满氧气是否可靠______(填是或否)
(4)上述实验表明:物质燃烧的程度与氧气的浓度有关,氧气浓度越大,燃烧越剧烈。请你 再举一例,将实验内容和实验现象填写在下表中:
实验内容 | 实验现象 | 实验结论 |
_______ | _______ | 氧气浓度越大,燃烧越剧烈 |
实验时硫不能取太多,是因为______。
【题目】某班同学为验证碳酸钠的化学性质,向盛有碳酸钠的试管中加入一定量的稀盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中(如图所示)。请回答问题:
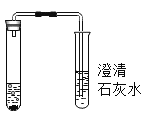
(1)右侧试管中澄清石灰水变浑浊的化学反应方程式为________。
(2)实验结束后,将两支试管中的所有物质倒入同一个废液缸中,充分反应后得到澄清溶液。同学们对废液中溶质的成分进行如下探究(忽略二氧化碳的影响) :
[提出问题]
废液中溶质的成分是什么?
[做出猜想]
猜想一: CaCl2、NaCl和HCl
猜想二: CaCl2、NaCl和Na2CO3
猜想三:______;
[进行讨论]
经过讨论,同学们一致认为猜想________是错误的。
[设计实验]
甲同学取少量废液于试管中,向其中加入硝酸银溶液,观察到白色沉淀,甲同学得出实验结论:猜想一正确。请你评价甲同学的实验及结论________。
请帮助乙同学完成实验报告
实验步骤 | 实验现象 | 实验结论 |
取少量废液于试管中,加入_________溶液 | 溶液中先产生气泡,后产生白色沉淀 | 猜想一成立 |
[反思拓展]
最终同学们确认了废液中溶质的成分。若将废液直接排入铸铁管道,危害是_______,可以加入过量的______(写化学式)处理废液,使之达到中性后排放。