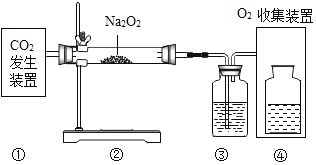
题目内容
【题目】我国有较长的海岸线,海水综合利用对促进经济发展有重要意义,如图是海水综合利用的一种流程示意图,请回答相关问题
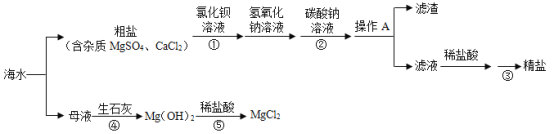
(1)从海水中获得粗盐的化学原理是______。
(2)操作A的名称为______,此操作中玻璃棒的作用是______。
(3)流程中⑤加入稀盐酸时发生反应的化学方程式为______。
【答案】蒸发结晶 过滤 引流 2HCl+Mg(OH)2═MgCl2+2H2O
【解析】
(1)因为氯化钠的溶解度受温度影响不大,所以从海水中获得粗盐利用的是蒸发结晶的原理,故填:蒸发结晶;
(2)操作A得到的是固体和液体,故是过滤操作,此操作中,玻璃棒的作用是引流;故填:过滤;引流;
(3)流程中⑤加入稀盐酸时,氢氧化镁与盐酸反应生成氯化镁和水,该反应的化学方程式为2HCl+Mg(OH)2═MgCl2+2H2O,故填:2HCl+Mg(OH)2═MgCl2+2H2O。

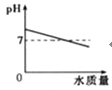
【题目】下列图象中能正确表示其变化过程的是( )
|
|
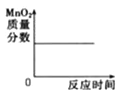
A.向pH=10的KOH溶液中不断加水稀释 | B.用一定质量的KClO3和MnO2的混合物制取O2 |
|
|
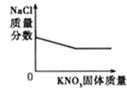
C.向FeCl3和HNO3的混合溶液中加入NaOH溶液直至过量 | D.20℃时,向一定质量的NaCl溶液中加入KNO3固体 |
【题目】小红、小军、小明三人化学学习小组在实验中,用到了三个分别盛有KCl溶液、KOH溶液、K2SO4溶液的滴瓶。
小军发现小红将三个滴瓶中的三只滴管混用,认为小红实验不规范,滴瓶中的试剂会因此受污染而无法再次使用,学习小组就盛有KCl溶液的滴瓶是否被另外两种试剂污染进行了如下探究。
(提出问题)该滴瓶中溶质的成分是什么?
(提出猜想)通过分析,提出如下猜想:
猜想Ⅰ:溶质成分只有KCl;
猜想Ⅱ:溶质成分为KCl和KOH;
猜想Ⅲ:溶质成分为_____;
猜想Ⅳ:溶质成分为KCl、KOH和K2SO4。
(实验探究)为证明猜想,小军设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 结论或解释 |
(1)取该滴瓶内溶液少量于试管中,向试管中加入适量BaCl2溶液 | 产生白色沉淀 | 该反应的化学方程式为 _____ |
(2)将上述反应后的混合液过滤,取滤液于另一支试管中,向该试管中加入氯化铁溶液 | _____ | 证明猜想Ⅳ成立 |
(实验反思)小明认为该实验方案并未证明猜想Ⅱ、Ⅲ是否成立,应补充相应实验予以证明,你是否赞同?_____(填“是”或“否”)。
【题目】请从 A 或B 两题中任选一个作答,若两题均作答,按 A 计分。
在一定条件下,Mg 和 MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。
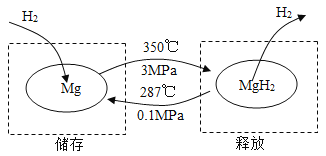
A | B |
(1)氢气储存时发生反应的化学方程式为_______。 (2)氢气很容易逃逸,若氢气存储效率为 10%,储存 1 kg 氢气,至少需要 Mg 的质量为_______ kg。 | (1)氢气释放时发生反应的化学方程式 为_______。 (2)理论上,52 kg MgH2最多能释放氢气的质量为_______ kg。 |
【题目】(题文)某校兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:
①取5只250mL 集气瓶,向 5 只集气瓶中分别装入 25mL、50mL、75mL、100mL、125mL 的 水,并用毛玻璃片盖住,依次编号为 1、2、3、4、5;
②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述 15 号瓶中的水 排去;③将带火星的木条依次插入 15 号瓶中,把观察到现象和计算数据,填入下表。

试回答下列问题:
(1)集气瓶2中氧气的体积分数为_____.(空气中氧气的体积分数以 21%计)
(2)根据以上实验事实,下列说法中正确的是_____(填写相应的字母).
A. 只有在纯氧中才能使带火星的木条复燃
B. 集气瓶中氧气的体积分数52.6%时,带火星的木条就能复燃
C. 只要有氧气存在就可使带火星的木条复燃。
(3)以上实验表明,使用带火星的小木条验满氧气是否可靠______(填是或否)
(4)上述实验表明:物质燃烧的程度与氧气的浓度有关,氧气浓度越大,燃烧越剧烈。请你 再举一例,将实验内容和实验现象填写在下表中:
实验内容 | 实验现象 | 实验结论 |
_______ | _______ | 氧气浓度越大,燃烧越剧烈 |
实验时硫不能取太多,是因为______。