题目内容
【题目】学习小组同学用某碳酸钠样品(含少量氯化钠,无其他杂质进行了如图所示的实验。请计算:

(1)生成二氧化碳的总质量为______g。
(2)样品中碳酸钠的质量分数______。(写出计算过程,结果保留到0.1%)
【答案】4.4 88.3%
【解析】
(1)根据质量守定律,参加反应的物质的总质量等于反应生成的物质的总质量,可知反应生成二氧化碳的质量为:12g+50g+60g-117.6g=4.4g,故填4.4;
(2)由题意可知第一次加50g稀盐酸生成二氧化碳质量为(12g+50g)-59.8g=2.2g,第二次又加入稀盐酸60g,生成二氧化碳的总质量为4.4g,说明稀盐酸有剩余,样品中碳酸钠完全反应,则计算过程为
解:设碳酸钠的质量为X,
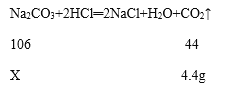
![]() =
=![]() 解得X=10.6g,样品中碳酸钠的质量分数=
解得X=10.6g,样品中碳酸钠的质量分数=![]() ×100%≈88.3%,
×100%≈88.3%,
答:样品中碳酸钠的质量分数为88.3%;故填88.3%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列实验方案合理的是![]()
![]()
实验目的 | 所用试剂或方法 | |
A | 除去CO中混有 | 通入氧气点燃 |
B | 量取 | 用100mL的量筒 |
C | 验证锌、铜、银的金属活动性 | 加稀盐酸 |
D | 除去 | 加过量的铜粉,过滤 |
A. A B. B C. C D. D