题目内容
石灰石是本地的重要矿产资源.培丰某水泥厂的化验员为测定刚购进的一批石灰石中碳酸钙的质量分数,用质量分析法测定某石灰石样品的纯度,其反应原理(杂质不与盐酸反应)CaCO3+2HCl=CaCl2+H2O+CO2↑.实验时,先将盛有足量稀盐酸的锥形瓶(两者质量之和为300.0g)放置于电子天平上,再将25.0g的石灰石加入锥形瓶中,立即发生反应.每隔3分种读得电子天平的数据如下:
| 反应的时间(min) | 3 | 6 | 9 | 12 | 15 |
| 电子天平读数(g) | 320.6 | 317.3 | 315.1 | M | 315.1 |
(2)表格中M的值是______g;.
(3)依据实验数据作出反应时间与容器中物质的质量减少(△m)间的关系的图象.
(4)计算该石灰石样品中碳酸钙的质量分数.
解:(1)锥形瓶口放一小团棉花,其主要作用是防止空气中的物质进入锥形瓶,影响实验结果;故填:防止空气中的物质进入锥形瓶;
(2)由图象的情况可判9min和15min时的数据相同,说明9min时反应已完成,那么12min时的数据应该和9min、15min时的一样,故表中M的值应该是315.1;故填:315.1;
(3)由于反应后物质的减轻值为二氧化碳的质量,所以可得到不同时间的生成二氧化碳的质量,其对应关系如表所示:
利用描点法可得图象如图: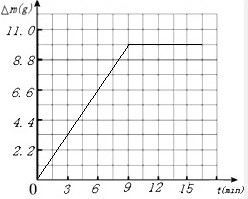 ;故填:
;故填: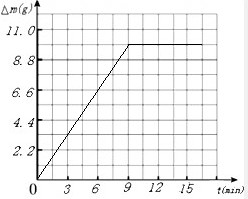 ;
;
(3)最终反应生成二氧化碳的质量为:325g-315.1=9.9g
设石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 9.9g

x=22.5g
石灰石样品中碳酸钙的质量分数为: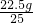 ×100%=90%
×100%=90%
答:(4)该石灰石中碳酸钙的质量分数为90%.
分析:(1)根据锥形瓶口放一小团棉花,其主要作用是防止空气中的物质进入锥形瓶进行解答;
(2)根据由图象的情况可判9min和15min时的数据相同,说明9min时反应已完成,那么12min时的数据应该和9min、15min时的一样进行解答;
(3)依据质量守恒定律的应用对反应后质量的减少值进行分别进行计算,求出不同时间中二氧化碳的数值,而后利用描点法绘制图象即可;
(4)根据化学方程式,可以求出各物质之间的质量比,进而求出碳酸钙的质量,再根据质量分数公式,可求出石灰石样品中碳酸钙的质量分数.
点评:解答本题的关键是根据质量守恒定律,准确判断出二氧化碳和反应后生成的溶液的质量.
(2)由图象的情况可判9min和15min时的数据相同,说明9min时反应已完成,那么12min时的数据应该和9min、15min时的一样,故表中M的值应该是315.1;故填:315.1;
(3)由于反应后物质的减轻值为二氧化碳的质量,所以可得到不同时间的生成二氧化碳的质量,其对应关系如表所示:
| 反应的时间(min) | 3 | 6 | 9 | 12 | 15 |
| 二氧化碳的质量(g) | 4.4 | 7.7 | 9.9 | 9.9 | 9.9 |
 ;故填:
;故填: ;
;(3)最终反应生成二氧化碳的质量为:325g-315.1=9.9g
设石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 9.9g

x=22.5g
石灰石样品中碳酸钙的质量分数为:
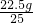 ×100%=90%
×100%=90%答:(4)该石灰石中碳酸钙的质量分数为90%.
分析:(1)根据锥形瓶口放一小团棉花,其主要作用是防止空气中的物质进入锥形瓶进行解答;
(2)根据由图象的情况可判9min和15min时的数据相同,说明9min时反应已完成,那么12min时的数据应该和9min、15min时的一样进行解答;
(3)依据质量守恒定律的应用对反应后质量的减少值进行分别进行计算,求出不同时间中二氧化碳的数值,而后利用描点法绘制图象即可;
(4)根据化学方程式,可以求出各物质之间的质量比,进而求出碳酸钙的质量,再根据质量分数公式,可求出石灰石样品中碳酸钙的质量分数.
点评:解答本题的关键是根据质量守恒定律,准确判断出二氧化碳和反应后生成的溶液的质量.

练习册系列答案
相关题目

 石灰石是我市的主要矿产之一.为了测定当地石灰石中碳酸钙的质量分数,某学校研究性学习小组进行了如下实验:取石灰石样品25g,向其中滴加稀盐酸,测定生成气体CO2的质量.加入稀盐酸的质量与产生CO2气体的质量关系如图所示.试计算(杂质不与酸反应,高温也不分解):
石灰石是我市的主要矿产之一.为了测定当地石灰石中碳酸钙的质量分数,某学校研究性学习小组进行了如下实验:取石灰石样品25g,向其中滴加稀盐酸,测定生成气体CO2的质量.加入稀盐酸的质量与产生CO2气体的质量关系如图所示.试计算(杂质不与酸反应,高温也不分解):