题目内容
石灰石是某地的主要矿产之一.该地某校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g平均分成4份进行实验,结果如下:
请仔细分析上表后回答:
(1)这种石灰石中碳酸钙的质量分数为多少?
(2)所用稀盐酸中溶质的质量分数为多少?
| 实 验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)这种石灰石中碳酸钙的质量分数为多少?
(2)所用稀盐酸中溶质的质量分数为多少?
分析:5g样品与50g盐酸反应生成1.76g二氧化碳,10g样品与50g盐酸反应生成3.52g二氧化碳,样品质量增加了一倍,生成的二氧化碳质量也增加了一倍,说明5g样品与50g盐酸反应只能生成1.76g二氧化碳,再根据加入的样品质量与5g的关系进行分析,可得m的数值;而后根据生成的二氧化碳的质量算出碳酸钙的质量和氯化氢的质量,据此分析解答.
解答:解:5g样品与50g盐酸反应生成1.76g二氧化碳,10g样品与50g盐酸反应生成3.52g二氧化碳,样品质量增加了一倍,生成的二氧化碳质量也增加了一倍,说明5g样品与50g盐酸反应只能生成1.76g二氧化碳,加入15g样品时,由于样品的质量是5g的三倍,所以生成二氧化碳的质量也是1.76g的 三倍即:1.76g×3=5.28g,但实际生成二氧化碳4.40g,说明样品并没有完全反应,盐酸被反应完了,即50g盐酸完全反应完只能生成4.40g二氧化碳,所以加入的样品再多,生成二氧化碳的质量也是4.40g,故m为4.4g;
(1)解:设10g样品中含碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.52g
根据:
=
解得x=8g,故这种石灰石中碳酸钙的质量分数为
×100%=80%
(3)解:设50g盐酸溶液中溶质的质量为y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
y 4.4g
=
y=7.3g,所以盐酸中溶质的质量分为:
×100%=14.6%.
答:(1)这种石灰石中碳酸钙的质量分数为80%;
(2)所用稀盐酸中溶质的质量分数为14.6%.
(1)解:设10g样品中含碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.52g
根据:
| 100 |
| x |
| 44 |
| 3.52g |
解得x=8g,故这种石灰石中碳酸钙的质量分数为
| 8g |
| 10g |
(3)解:设50g盐酸溶液中溶质的质量为y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
y 4.4g
| 73 |
| y |
| 44 |
| 4.4g |
y=7.3g,所以盐酸中溶质的质量分为:
| 7.3g |
| 50g |
答:(1)这种石灰石中碳酸钙的质量分数为80%;
(2)所用稀盐酸中溶质的质量分数为14.6%.
点评:解答本题关键是要知道根据图表中数据分析哪种物质过量的方法,计算样品中碳酸钙含量时,必须要根据样品完全反应的那次进行计算,计算盐酸质量分数时,要根据盐酸完全反应的那次进行计算.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
石灰石是我市的主要矿产之一.某学校研究性学习小组为了测定当地矿山中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质既不溶于水,也不和酸发生反应)
(1)上表中m的数值是 .
(2)试计算这种石灰石中碳酸钙的质量分数.(结果精确到0.1%)
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 15 | 22.5 | 30 | 37.5 |
| 生成的CO2质量/g | 4.4 | 6.6 | 8.0 | m |
(2)试计算这种石灰石中碳酸钙的质量分数.(结果精确到0.1%)
 石灰石是我省的主要矿产之一.我校研究性学习小组为了测定某市矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质不与稀盐酸反应)
石灰石是我省的主要矿产之一.我校研究性学习小组为了测定某市矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质不与稀盐酸反应)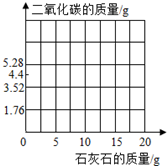 石灰石是我省的主要矿产之一.我校研究性学习小组为了测定某市矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质不与稀盐酸反应)
石灰石是我省的主要矿产之一.我校研究性学习小组为了测定某市矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质不与稀盐酸反应) 石灰石是我市的主要矿产之一.为了测定当地石灰石中碳酸钙的质量分数,某学校研究性学习小组进行了如下实验:取石灰石样品25g,向其中滴加稀盐酸,测定生成气体CO2的质量.加入稀盐酸的质量与产生CO2气体的质量关系如图所示.试计算(杂质不与酸反应,高温也不分解):
石灰石是我市的主要矿产之一.为了测定当地石灰石中碳酸钙的质量分数,某学校研究性学习小组进行了如下实验:取石灰石样品25g,向其中滴加稀盐酸,测定生成气体CO2的质量.加入稀盐酸的质量与产生CO2气体的质量关系如图所示.试计算(杂质不与酸反应,高温也不分解):