题目内容
【题目】FeCl3溶液能对过氧化氢溶液的分解起催化作用。某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响。
写出本实验发生反应的符号表达式_______;
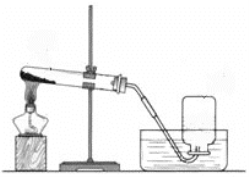
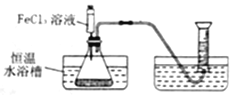
I.分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,如图观察到____________,就可以粗略判断,得出实验结果。为进一步判断上述实验结论的准确性,运用上图,小刚同学进行了如下实验方案设计。
II.[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间。
[方案二]在不同过氧化氢溶液下,测定______________;
方案二的实验测量结果:
实验序号 物理量 | 30%H2O2溶液的体积(mL) | 2%FeCl3溶液的体积(mL) | 加入H2O的体积(mL) | 反应的时间(min) | 生成O2的体积(mL) |
1 | 5 | x | 20 | 5 | V1 |
2 | 10 | 3 | 15 | y | V2 |
表中x=___________,y=_____________;
实验结论:通过测量,若V1______V2(填“>”、“=”或“<”),说明___。
【答案】略 不同浓度的过氧化氢溶液产生气泡的速率不同 相同时间下生成氧气的体积 3 5 > 在相同浓度的催化剂条件和相同时间下,过氧化氢浓度越大,分解速率越快(或在相同浓度的催化剂条件和相同时间下,过氧化氢浓度小的,分解速率慢)
【解析】
(1)过氧化氢在氯化铁作催化剂的条件生成水和氧气,反应的符号表达式:过氧化氢![]() 水+氧气;
水+氧气;
Ⅰ.分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,从反应速率的快慢就可得出结论;
Ⅱ.[方案二]在不同过氧化氢浓度下,测定相同时间收集气体的体积;
分析方案二的实验测量结果,可得控制变量x=3,y=5;
通过测量,若V1<V2,可得出结论:其他条件相同时,过氧化氢的浓度越大,生成氧气的速率越快。