题目内容
【题目】下面是实验室常用仪器组成的装置,请回答下列问题:
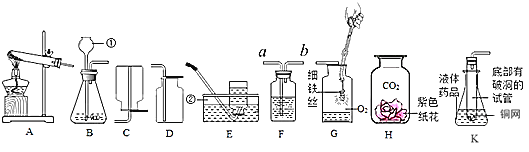
(1)指出标号仪器的名称:①________②__________;
(2)用氯酸钾制取氧气的化学方程式为__________;实验室制取二氧化碳的反应方程式是________;若用F装置进行排空气法收集CO2,CO2从F装置的_____(填“a”或“b”)导管口通入;
(3)已知氨气是一种极易溶于水的气体,密度比空气小,实验室可用氧化钙固体与浓氨水在常温下混合制成氨气(NH3),则应选用的气体发生装置是_________(填装置序号),收集装置是________(填装置序号)。用收集到的氧气完成如G图所示实验,G中发生反应的化学方程式是__________,G中瓶底要放少量水的目的是_____________。
(4)K图是某同学利用底部有破洞的试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点:___________。若将铜网改成铁网,产生的后果之一是收集到的气体不纯,原因是(用化学方程式表示)___________。
【答案】长颈漏斗 水槽 2KClO3![]() 2KCl+3O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ a B C 3Fe+2O2
2KCl+3O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ a B C 3Fe+2O2![]() Fe3O4 防止高温熔融物使瓶底炸裂 控制反应的发生和停止 Fe+2HCl═FeCl2+H2↑
Fe3O4 防止高温熔融物使瓶底炸裂 控制反应的发生和停止 Fe+2HCl═FeCl2+H2↑
【解析】
(1)据图可知仪器①是长颈漏斗,②是水槽;
(2)用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式为:2KClO3![]() 2KCl+3O2↑;实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;若用F装置进行排空气发收集CO2,CO2从F装置的长管a进入,因为氧气的密度比空气大;
2KCl+3O2↑;实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;若用F装置进行排空气发收集CO2,CO2从F装置的长管a进入,因为氧气的密度比空气大;
(3)实验室可用氧化钙固体与浓氨水在常温下混合制成氨气(NH3),因此不需要加热,应用装置B;氨气是一种极易溶于水的气体,密度比空气小,因此只能用向下排空气法收集,应用装置C;铁和氧气在点燃的条件下生成四氧化三铁,反应的化学方程式为:3Fe+2O2![]() Fe3O4;G中瓶底要放少量水的目的是:防止高温熔融物使瓶底炸裂;
Fe3O4;G中瓶底要放少量水的目的是:防止高温熔融物使瓶底炸裂;
(4)K图的优点是:控制反应的发生和停止;若将铜网改成铁网,产生的后果之一是收集到的气体不纯,原因是铁和盐酸反应生成氯化亚铁和氢气,氢气是杂质,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑。

【题目】化学兴趣课上,同学们对过氧化钠(Na2O2)可以做供氧剂产生了浓厚兴趣,于是在老师的指导下展开了以下探究活动。
(提供资料)① 二氧化碳与过氧化钠反应生成氧气和另一种物质。
② 碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)与盐酸反应均能生成CO2。
③ 2Na2O2 + 2H2O= 4NaOH + O2↑。
(1)证明二氧化碳与过氧化钠反应产生氧气并收集一瓶氧气。同学们在老师的指导下设计了如下图所示装置。
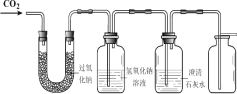
① 如何证明氧气已经收集满 ______。
② 氢氧化钠溶液的作用是除去未反应的二氧化碳,若观察到________ ,说明二氧化碳已经除尽。
(2)探究二氧化碳与过氧化钠反应生成的另一种物质。
(猜想与假设)下面是同学们提出的3种猜想。
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
通过对反应物中有关元素的组成分析,你认为猜想_____是不正确的,理由是____。
(进行实验)同学们通过以下实验验证了另一种物质,请完成下述实验报告。
实验操作 | 实验现象 | 实验结论 |
取少量CO2与Na2O2反应后的固体于试管中,___________。 | 有大量气泡产生,澄清石灰水变浑浊。 | 猜想_____ 是正确的。 |
(反思与评价)若用人呼出的气体通过上图装置,证明二氧化碳与过氧化钠反应生成了氧气,你是否同意这种做法,并阐述理由____ 。
【题目】FeCl3溶液能对过氧化氢溶液的分解起催化作用。某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响。
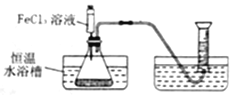
写出本实验发生反应的符号表达式_______;
I.分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,如图观察到____________,就可以粗略判断,得出实验结果。为进一步判断上述实验结论的准确性,运用上图,小刚同学进行了如下实验方案设计。
II.[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间。
[方案二]在不同过氧化氢溶液下,测定______________;
方案二的实验测量结果:
实验序号 物理量 | 30%H2O2溶液的体积(mL) | 2%FeCl3溶液的体积(mL) | 加入H2O的体积(mL) | 反应的时间(min) | 生成O2的体积(mL) |
1 | 5 | x | 20 | 5 | V1 |
2 | 10 | 3 | 15 | y | V2 |
表中x=___________,y=_____________;
实验结论:通过测量,若V1______V2(填“>”、“=”或“<”),说明___。