题目内容
【题目】如下图是钠元素和氯元素在元素周期表中的信息和四种粒子的结构示意图。
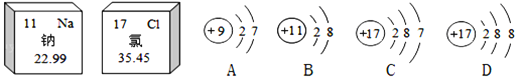
请回答下列问题:
(1)钠原子的相对原子质量是_____。
(2)阴离子的结构示意图是_____(填字母),其离子符号为_________。
(3)A和C两种粒子的___________________相同,所以它们具有相似的化学性质。
(4)BD两种粒子形成的化合物的化学式为____________。
【答案】22.99 D Cl- 最外层电子数 NaCl
【解析】
(1) 元素周期表每一小方格下方数据表示相对原子质量,所以钠元素的相对原子质量为:22.99;
(2) 阴离子核外电子数大于核内质子数阳离子核外电子数小于核内质子数,所以阴离子是D,带一个单位负电荷的氯离子,符号为:Cl-;
(3) 决定元素的化学性质的是原子的最外层电子数,A粒子C粒子的最外层电子数相同,A粒子化学性质与C粒子化学性质相似;
(4) B的质子数是11,属于钠元素,化合价为+1价,D的质子数是17,与金属形成化合物时化合价为-1价,形成的化合物的化学式是:NaCl。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】FeCl3溶液能对过氧化氢溶液的分解起催化作用。某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响。
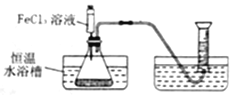
写出本实验发生反应的符号表达式_______;
I.分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,如图观察到____________,就可以粗略判断,得出实验结果。为进一步判断上述实验结论的准确性,运用上图,小刚同学进行了如下实验方案设计。
II.[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间。
[方案二]在不同过氧化氢溶液下,测定______________;
方案二的实验测量结果:
实验序号 物理量 | 30%H2O2溶液的体积(mL) | 2%FeCl3溶液的体积(mL) | 加入H2O的体积(mL) | 反应的时间(min) | 生成O2的体积(mL) |
1 | 5 | x | 20 | 5 | V1 |
2 | 10 | 3 | 15 | y | V2 |
表中x=___________,y=_____________;
实验结论:通过测量,若V1______V2(填“>”、“=”或“<”),说明___。