题目内容
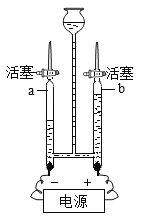
【题目】CO混有少量的CO2,用右图装置收集瓶较纯净的CO,说法错误的是
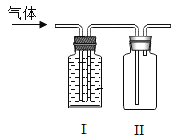
A.I中溶液是氢氧化钠溶液
B.气体通入后,I中的液体会流向II
C.反应结束后,CO收集在II中
D.若I中导气管始终保持液封,则不必尾气处理
【答案】C
【解析】
A、一氧化碳不与氢氧化钠溶液反应,二氧化碳能与氢氧化钠溶液反应,因此可以用将混合的气体通过足量的氢氧化钠溶液除去一氧化碳中的二氧化碳,该选项说法正确;
B、一氧化碳难溶于水,密度比水小,进入I后一氧化碳会聚集到瓶口,使瓶内压强增大,会将瓶中液体排到II中,故正确;
C、一氧化碳难溶于水,密度比水小,进入I后一氧化碳会聚集到瓶口,使瓶内压强增大,会将瓶中液体排到II中,一氧化碳被收集在I中,故错误;
D、一氧化碳难溶于水,密度比水小,进入I后一氧化碳会聚集到瓶口,使瓶内压强增大,会将瓶中液体排到II中,一氧化碳被收集在I中,不需要尾气处理,故正确。
故选C。

【题目】阅读下面科普短文。
生活中我们谈到“细菌”往往会心惊胆战。其实细菌不仅仅只有危险的一面,如果掌握了它们的特性,很多细菌也可以为我们服务。氧化亚铁硫杆菌(以下简称为T·f菌,见图左)是一种细菌,它被广泛应用于治理废气、废渣等有害物质。例如用T· f菌脱除工业废气中的一种有毒、有腐蚀性的气体——硫化氢(H2S)。其作用原理如图所示。
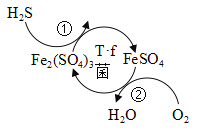
这个净化过程中,Fe2(SO4)3溶液在常温常压下就可以将废气中的H2S脱出,生成FeSO4 。FeSO4在酸性溶液中、在T· f菌的帮助之下,只需少量的氧气就又可以转化为Fe2(SO4)3 ,同时释放的能量还能供给T· f菌生长。用这种方法处理废气大大降低了治污的成本,脱除率达到99.97%,且无废物排出。但要达到高效的关键是要保证体系内FeSO4 浓度的稳定,一旦FeSO4 浓度降低,T· f菌就会像缺少食物一样逐渐失去活性。实际应用过程发现Fe2(SO4)3在pH=l.9时会发生一定的变化,生成了铁的沉淀物——黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕,并在pH=3.2时沉淀完全,使得溶液中的总铁浓度下降。可见溶液的pH值对这个方法的效果有一定影响。实验测得30℃时,不同pH环境下T· f菌的活性不同,表现为FeSO4溶液转化为Fe2(SO4)3溶液的速率不同,如下表:
pH | 0.9 | 1.2 | 1.5 | 1.9 | 2.1 | 2.4 | 2.7 | 3.0 |
FeSO4溶液转化为Fe2(SO4)3速率/(gL﹣1h﹣1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
回答下列问题:
(1)在环节①中化合价升高的元素是_____(填写元素符号)。
(2)环节②的反应原理为:4 F e S O4+ O2+ 2X![]() 2F e2(S O4)3+2H2O其中物质“X”的化学式为_____。
2F e2(S O4)3+2H2O其中物质“X”的化学式为_____。
(3)黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕中铁元素与硫元素的原子个数比为__________。
(4)用T·f菌脱除废气中的H2S气体的优点是_______(写出1点即可)
(5)请结合文中信息,判断工业用T·f菌脱硫应选择的最佳pH范围是_____<pH<__。