��Ŀ����
����Ŀ��ʵ��С��������ͼ��ʾװ�ò����������������������ȡ�óɹ���
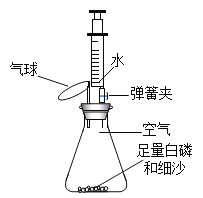
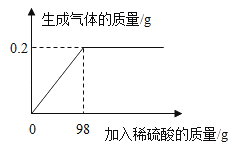
[��������]�����Ż��40�档
[�������]�������Լռ����������Ķ��٣�
[ʵ����]��ƿ�ڿ������Ϊ200mL��ע������ˮ�����Ϊ50mL����װ�����������á�
[ʵ��̽��]װ��ҩƷ����ͼ��ʾ���Ӻ��������н����ɼС��Ƚ���ƿ�ײ�������ˮ�У����ܿ챻��ȼ��Ȼ����ƿ����ˮ��ȡ����
[�������]
��1������ƿ�ײ�������ˮ�У����ױ���ȼ��˵��ȼ�ղ���ȱ�ٵ�һ������_______________������֮�⣬ȼ�ջ���Ҫ��������_________________��_____________________��
��2������ȼ�յ�������_____________________��д������ȼ�յĻ�ѧ����ʽ��_____________________ ��������Ӧ������____________________��
��3�������İ�������ƿ��δ��ȫ��ȼ�գ�˵��ƿ��ʣ������______ȼ�գ��֧�֡���֧�֡�����
��4��������ʵ������У��ɹ۲쵽����ı仯��__________________��
��5��������Ϩ����ƿ��ȴ�����º��ɼУ����ɹ۲쵽�������ǣ���ע�����е�ˮ�Զ�����������ڵ�ע�����е�ˮ��ʣԼ10mLʱֹͣ������������Щ��������ԭ���ǣ�_______________��_________________��
[�ó�����]����Լռ�����������1/5 ��
[��չӦ��]
��6����ͬѧ�����������Ӧǰ��������װ�õ�����Ϊm�ˣ���Ӧ�������Ϩ����ƿ��ȴ�����£�������ƿ��ڵ�ˮ���ٴγ�������װ�õ�����Ϊ_________m��(����ڡ��������ڡ����� С�ڡ�)���жϵ�������_______________________��
���𰸡���ȼ����¶�Ҫ�ﵽ�Ż���ȼ�����������ð�������İ��̡�����4P + 5O2��ȼ2P2O5���Ϸ�Ӧ��֧���ȹĺ�����ȼ����������ƿ�е�������ʹƿ����ѹ������ƿ������Լռ40mL����ע�����е�ˮ������ƿԼ40mL��ƿ����ѹ������൱����������������Ҳ�ɣ����ڶ�����������ƿ������Լռ40mL�������������غ㶨��
����������1��������ˮ�иı���Ϊ�¶ȣ����Ϊ�¶���ﵽ�Ż�㣻����Ҫ�������Ϳ�ȼ���2������ȼ�����ɹ������������ף����������İ�������ӦΪ����������ȼ�������������ף�������������һ�֣����ڻ��Ϸ�Ӧ����3����ȼ�ﻹ���У��¶�Ҳ�ﵽ�Ż�㣬ȴϨ����˻�ȱ��ȼ�Ե����壬��ô˵��ʣ�����岻֧��ȼ�գ���4��ȼ�շ���ʹ�¶�������ѹ����������𣬺�Ӧֹͣ��ȴ�¶Ȼָ�������������������ʹ��ѹ��С��������£���5������������ʹƿ����ѹ��С��ˮ���������Ϊ���ĵ����������������Լռ���������1/5����6��Ϊ�ܱ�ϵͳ�һ�ѧ��Ӧ���������غ㶨�ɣ�����������䣻��ѧ��Ӧ���������غ㶨��

����Ŀ����1��A��F�dz��л�ѧ�еij������ʣ���ͼ��ʾ������֮���ת����ϵ��ͼ�в��ַ�Ӧ���������δȫ���������֪��A����Ȼ������Ҫ�ɷ֣�B�ڳ�����ΪҺ̬��F�Ǻ�ɫ��ĩ��

�� A���ʵĻ�ѧʽΪ______________��
�� B��D��__________��Ӧ������ȡ������ȡ�����
�� ��C��E�ķ�Ӧ�У�C���ʷ���______________���������Ӧ����ԭ��Ӧ������
�� д��E��F��Ӧ�Ļ�ѧ����ʽ��_________________________��
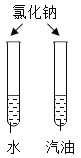
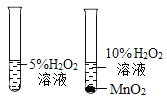
��2����ƶԱ�ʵ�飬���Ʊ�����ѧϰ��ѧ����Ҫ���������жԱ�ʵ�鲻�ܴﵽĿ�ĵ���______��
��� | A | B |
ʵ����� |
|
|
ʵ��Ŀ�� | ̽��ͬ�������ڲ�ͬ�ܼ��е��ܽ��� | ̽��MnO2�Թ�������ֽ��Ӱ�� |