题目内容
静怡同学将锌和稀盐酸进行了如下表的三次实验,请你对她实验数据进行分析.通过计算回答问题.| 第一次 | 第二次 | 第三次 | |
| 所用锌的质量(克) | 13 | 16.25 | 26 |
| 所用稀盐酸质量(克) | 150 | 150 | 150 |
| 生成H2质量(克) | X | 1.25X | 1.5X |
(2)小叶同学所用稀盐酸中溶质质量分数是______;
(3)第三次反应后所得的溶液中,溶质质量分数是______.
【答案】分析:(1)根据第一次实验中锌完全反应,而盐酸有剩余,由锌的质量求出氢气的质量即可;
(2)根据第三次中盐酸完全反应而锌有剩余,利用氢气的质量求出150g中盐酸中溶质的质量进而求出所用稀盐酸中溶质质量分数;
(3)根据第三次反应后所得的溶液为氯化锌溶液进行解答.
解答:解:(1)第一次实验中锌完全反应,而盐酸有剩余,设氢气的质量为X.
Zn+2HCl═ZnCl2+H2↑
65 2
13g X

X=0.4g
答:氢气的质量为0.4g.
(2)第三次中盐酸完全反应而锌有剩余,利设150g中盐酸中溶质的质量为,氢气的质量=1.5×0.4g=0.6g.
Zn+2HCl═ZnCl2+H2↑
73 2
y 0.6g

y=21.9g
稀盐酸中溶质质量分数= =14.6%
=14.6%
(3)设生成氯化锌的质量为z,反应锌的质量为w.
Zn+2HCl═ZnCl2+H2↑
65 136 2
w z 0.6g

z=40.8g
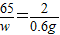
w=19.5g
反应后所得的溶液中溶质质量分数= ≈24.2%
≈24.2%
答:反应后所得的溶液中,溶质质量分数是24.2%.
故答案为:
(1)0.4;( 2)14.6%;( 3)24.2%.
点评:解答本题的关键是根据图表数据分析出恰好完全反应的同学,再根据所给信息进行进一步计算.
(2)根据第三次中盐酸完全反应而锌有剩余,利用氢气的质量求出150g中盐酸中溶质的质量进而求出所用稀盐酸中溶质质量分数;
(3)根据第三次反应后所得的溶液为氯化锌溶液进行解答.
解答:解:(1)第一次实验中锌完全反应,而盐酸有剩余,设氢气的质量为X.
Zn+2HCl═ZnCl2+H2↑
65 2
13g X

X=0.4g
答:氢气的质量为0.4g.
(2)第三次中盐酸完全反应而锌有剩余,利设150g中盐酸中溶质的质量为,氢气的质量=1.5×0.4g=0.6g.
Zn+2HCl═ZnCl2+H2↑
73 2
y 0.6g

y=21.9g
稀盐酸中溶质质量分数=
 =14.6%
=14.6%(3)设生成氯化锌的质量为z,反应锌的质量为w.
Zn+2HCl═ZnCl2+H2↑
65 136 2
w z 0.6g

z=40.8g
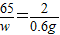
w=19.5g
反应后所得的溶液中溶质质量分数=
 ≈24.2%
≈24.2%答:反应后所得的溶液中,溶质质量分数是24.2%.
故答案为:
(1)0.4;( 2)14.6%;( 3)24.2%.
点评:解答本题的关键是根据图表数据分析出恰好完全反应的同学,再根据所给信息进行进一步计算.

练习册系列答案
相关题目
静怡同学将锌和稀盐酸进行了如下表的三次实验,请你对她实验数据进行分析.通过计算回答问题.
| 第一次 | 第二次 | 第三次 | |
| 所用锌的质量(克) | 13 | 16.25 | 26 |
| 所用稀盐酸质量(克) | 150 | 150 | 150 |
| 生成H2质量(克) | X | 1.25X | 1.5X |
(2)小叶同学所用稀盐酸中溶质质量分数是________;
(3)第三次反应后所得的溶液中,溶质质量分数是________.