题目内容
(5分)实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,设计了实验,实验过程如下:
实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说明氢氧化钠已变质,变质的原因是_____________________(用化学方程式表示)。
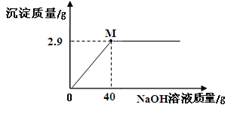
实验二:
通过实验二,能进一步推算出氢氧化钠变质的程度。请列式计算实验二中16.0样品中各成分的质量。
结论:16.0 g样品中已变质的氢氧化钠的质量是_______g。
实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说明氢氧化钠已变质,变质的原因是_____________________(用化学方程式表示)。
实验二:

通过实验二,能进一步推算出氢氧化钠变质的程度。请列式计算实验二中16.0样品中各成分的质量。
结论:16.0 g样品中已变质的氢氧化钠的质量是_______g。
2NaOH + CO2 ="=" Na2CO3 + H2O 8
试题分析:实验一:氢氧化钠变质,是吸收了空气中的二氧化碳,化学方程式为:2NaOH + CO2 ="=" Na2CO3 + H2O
实验二:发生的化学方程式:CaCl2+Na2CO3==CaCO3↓+2NaCl,根据题中的信息,碳酸钙的质量为10g,再根据方程式中Na2CO3与CaCO3的质量关系106:100,可求出Na2CO3的质量,进而根据方程式:2NaOH + CO2 ="=" Na2CO3 + H2O,即可算出已变质的氢氧化钠的质量
解:设Na2CO3的质量为x
CaCl2+Na2CO3==CaCO3↓+2NaCl
100
X 10g
106:100=x:10g x=10.6g
设已变质的氢氧化钠的质量为y
2NaOH + CO2 ="=" Na2CO3 + H2O
106
Y 10.6g
80:106=y:10.6g y=8g

练习册系列答案
相关题目