题目内容
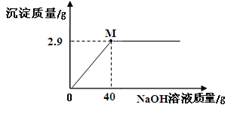
华雪同学对氯化镁固体样品(仅含杂质NaCl)进行如下检测:取5.0g样品溶于一定量的水中得到25.0g溶液,再加入溶质质量分数为10%的氢氧化钠溶液,实验时得到沉淀的质量与加入NaOH溶液的质量关系如图所示:请计算在M点时所得溶液溶质质量分数(最后结果精确到0.1%)。

9.8%
试题分析:根据图像,可以直观看出当加入氢氧化钠溶液质量为40g时,反应结束,且生成沉淀质量为2.9g,根据化学反应方程式:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,最后所得溶液为NaCl溶液
解:设生成2.9g氢氧化镁沉淀时,消耗氯化镁的质量为x,生成氯化钠的质量是y
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58 117
x 2.9g y
95∶x=58∶2.9g
x=95×2.9g/58=4.75g
58∶2.9g =117∶y
y=117×2.9g/58=5.85g
M点时所得溶液中的溶质质量分数=(5g-4.75g+5.85g)/(25.0g+40g-2.9g)×100%=9.8%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
