��Ŀ����
������������õ����յȹ�Ч�����������ϲ����������ʾ�������к�̼���80��93%��������4��14%��ˮ��2��4%��ʮ���ְ����ᡢ28����Ԫ�أ�Ȼ��һЩ���������û��յı��Ǽ��Ϲ�ҵ�������������Ƶ�ҩˮ������ϴ����ɹ�Ժ�ֱ�Ӽӹ����ۣ�����Ҫ�ɷ��ǣ�̼��ƣ������������������ƣ�������ij��ѧ��ȤС����Ʊ��������飬���ⶨ������̼��ƺ�����ʵ��̽��������
��̽��һ�����������������١�
����ֱ�����ˮ����ֽ��衢���ã��ⶨ�ϲ���Һ��pH����pH�� ��7�������������=����Ϊ�����飬�������� ����
��̽�������ⶨ������̼��ƺ�����
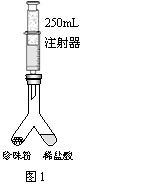
С������ͼ��ʾװ�òⶨ���������̼��Ƶĺ�����ʵ�鷽�����£�

��1�����װ�������ԣ���ͼ1����װ���ú�ע�������������Ϊ250mL�������ǻ�����Ħ�������أ���ͬ���ӿ̶�10mL�����������̶�20mL������ ��������������������������ã���2����ͼ1����װ�������װ��1.1g �����������Ʒ���ҹ��ڵ���һ������ϡ���ᣬע���������Ƶ��ײ����ٴ�����װ�ã�
��3���跨ʹ���������ڵ�ҩƷ��ϣ���Ӧ�������ȡע��������Ϊ220mL��
��4�����ݴ���������ø��������̼��Ƶ���������Ϊ�� ����[�ѡ�CO2����2g/L���������С�����1λ]
��ʵ��˼��������1����ʵ���еķ�Ӧԭ������ �����û�ѧ����ʽ��ʾ����
��2������ע�������أ���ʵ�鷽��������۵����������Ƿ������Ҫ���� ����
��3����̽�������еĵڣ�3�������������ҩƷ�ķ������� ����
��4����ʵ��װ������ϵ��ŵ������� ����д��1�㼴�ɣ���
��̽��һ�������������в�����������ʹ����Һ�ʼ��ԣ�
��̽��������1���ɿ�ע�����������������»ص�10mL�̶ȴ�����4��90.9%��
��ʵ�鷴˼����1��CaCO3+2HCl��CaCl2+H2O+CO2����
��2����Ҫ�������������̫������CO2������������ע�����������ƣ�����������
��3��������װ��������б��ʹϡ����������߹��ڣ���4����������Ͳ�����������
��������
�����������������ṩ����Ϣ���з�����������ijɷ��к����������ƣ�ʹ��ˮ��Һ�ʼ��ԣ����ݲ����Ķ�����̼�����������Լ������Ʒ��̼��Ƶ�������������������Ķ�����̼�����������ע�����IJ�����Χ���������вⶨ������Ʒ��������Ҫ���ƣ��ݴ˽�ɡ�
��̽��һ���������к����������ƣ�ʹ��Һ�ʼ��ԣ�pH����7����������������в�����������ʹ����Һ�ʼ��ԣ�
��̽��������1����װ�����������ã���ע���������������ɿ���ʱ���������»ص�ԭ����λ�ã�����ɿ�ע�����������������»ص�10mL�̶ȴ���
��4��ע��������Ϊ220mL�������ɵĶ�����̼������Ϊ��0.22L��2g/L��0.44g����̼��Ƶ�����Ϊx
CaCO3+2HCl��CaCl2+H2O+CO2��
100 44
x 0.44g
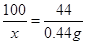
���x��1g
����������̼��Ƶ���������Ϊ��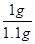 ��100%��90.9%�����90.9%��
��100%��90.9%�����90.9%��
��ʵ�鷴˼����1����ʵ���ԭ��������̼�����ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼�����CaCO3+2HCl��CaCl2+H2O+CO2����
��2����������Ķ�����̼�����������ע�����IJ�����Χ���������вⶨ������Ʒ��������Ҫ���ƣ������Ҫ�������������̫������CO2������������ע�����������ƣ�����������
��3��ΪʹҩƷ��ϣ����Խ�װ��������б��������������߹ع��ڣ����������װ��������б��ʹϡ����������߹��ڣ�
��4����ƴ�ʵ��װ�ã������ڲ������ɵĶ�����̼������������������Ͳ�����������
���㣺����ʵ��̽�����ʵ���ɳɷ��Լ�����

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�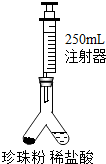 ��2013?������һģ��������������õ����յȹ�Ч�����������ϲ����������ʾ�������к�̼���80-93%��������4-14%��ˮ��2-4%��ʮ���ְ����ᡢ28����Ԫ�أ�Ȼ��һЩ���������û��յı��Ǽ��Ϲ�ҵ�������������Ƶ�ҩˮ������ϴ����ɹ�Ժ�ֱ�Ӽӹ����ۣ�����Ҫ�ɷ��ǣ�̼��ƣ������������������ƣ�������ij��ѧ��ȤС����Ʊ��������飬���ⶨ������̼��ƺ�����ʵ��̽��������
��2013?������һģ��������������õ����յȹ�Ч�����������ϲ����������ʾ�������к�̼���80-93%��������4-14%��ˮ��2-4%��ʮ���ְ����ᡢ28����Ԫ�أ�Ȼ��һЩ���������û��յı��Ǽ��Ϲ�ҵ�������������Ƶ�ҩˮ������ϴ����ɹ�Ժ�ֱ�Ӽӹ����ۣ�����Ҫ�ɷ��ǣ�̼��ƣ������������������ƣ�������ij��ѧ��ȤС����Ʊ��������飬���ⶨ������̼��ƺ�����ʵ��̽��������

 ����ֱ�����ˮ����ֽ��衢���ã��ⶨ�ϲ���Һ��pH����pH �� 7���>����<����=����Ϊ�����飬������ �� ��
����ֱ�����ˮ����ֽ��衢���ã��ⶨ�ϲ���Һ��pH����pH �� 7���>����<����=����Ϊ�����飬������ �� ��