题目内容
 (2013?海安县一模)珍珠粉以其良好的养颜等功效,获得消费者喜爱.资料显示:珍珠中含碳酸钙80-93%、蛋白质4-14%、水份2-4%、十几种氨基酸、28种微量元素.然而一些不法分子用回收的贝壳加上工业用氢氧化钠配制的药水进行清洗、晾晒以后直接加工销售,其主要成分是:碳酸钙,及少量残留氢氧化钠.以下是某化学兴趣小组设计辨别真假珍珠,并测定珍珠中碳酸钙含量的实验探究方案.
(2013?海安县一模)珍珠粉以其良好的养颜等功效,获得消费者喜爱.资料显示:珍珠中含碳酸钙80-93%、蛋白质4-14%、水份2-4%、十几种氨基酸、28种微量元素.然而一些不法分子用回收的贝壳加上工业用氢氧化钠配制的药水进行清洗、晾晒以后直接加工销售,其主要成分是:碳酸钙,及少量残留氢氧化钠.以下是某化学兴趣小组设计辨别真假珍珠,并测定珍珠中碳酸钙含量的实验探究方案.【探究一】辨别市售珍珠真与假.
将其分别溶于水,充分搅拌、静置,测定上层清液的pH;若pH
>
>
7(填“>”或“<”或“=”)为假珍珠,理由是假珍珠中残留氢氧化钠使得溶液呈碱性
假珍珠中残留氢氧化钠使得溶液呈碱性
.【探究二】测定珍珠中碳酸钙含量.
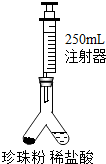
小王用如图所示装置测定该珍珠粉中碳酸钙的含量.实验方案如下:
(1)检查装置气密性:按图1连接装好置后,将注射器活塞(规格为250mL,不考虑活塞的摩擦和自重,下同)从刻度10mL处向上拉至刻度20mL处,
松开注射器活塞,活塞重新回到10mL刻度处
松开注射器活塞,活塞重新回到10mL刻度处
(填操作和现象),则气密性良好;(2)在图1异型装置左管内装入1.1g 上述珍珠粉样品,右管内倒入一定量的稀盐酸,注射器活塞推到底部,再次连接装置;
(3)设法使左右两管内的药品混合,反应结束后读取注射器读数为220mL;
(4)数据处理:计算得该珍珠粉中碳酸钙的质量分数为
90.9%
90.9%
.[ρ〔CO2〕=2g/L,结果保留小数点后1位]【实验思考】((1)此实验中的反应原理是
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
(用化学方程式表示);(2)考虑注射器因素,该实验方案对珍珠粉的用量多少是否必须作要求?
需要.若珍珠粉用量太大,生成CO2气体的体积超过注射器容量限制,则无法测量
需要.若珍珠粉用量太大,生成CO2气体的体积超过注射器容量限制,则无法测量
;(3)【探究二】中的第(3)步,混合两种药品的方法是
将异型装置向左倾斜,使稀盐酸流入左边管内
将异型装置向左倾斜,使稀盐酸流入左边管内
;(4)该实验装置设计上的优点在于
方便操作和测量气体的体积
方便操作和测量气体的体积
(写出1点即可).分析:根据题干提供的信息进行分析,假珍珠的成分中含有氢氧化钠,使其水溶液呈碱性;根据产生的二氧化碳气体的体积可以计算出样品中碳酸钙的质量分数,如果产生的二氧化碳的体积超过了注射器的测量范围,则无法进行测定,故样品的质量需要控制,据此解答即可.
解答:解:【探究一】假珍珠中含有氢氧化钠,使溶液呈碱性,pH大于7,故填:>,假珍珠中残留氢氧化钠使得溶液呈碱性;
【探究二】(1)若装置气密性良好,则当将注射器活塞拉上再松开的时候,活塞会重新回到原来的位置,故填:松开注射器活塞,活塞重新回到10mL刻度处;
(4)注射器读数为220mL,则生成的二氧化碳的质量为:0.22L×2g/L=0.44g,设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.44g
=
x=1g
则该珍珠粉中碳酸钙的质量分数为:
×100%≈90.9%
故填:90.9%;
【实验反思】(1)此实验的原理是利用碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)如果产生的二氧化碳的体积超过了注射器的测量范围,则无法进行测定,故样品的质量需要控制,故填:需要,若珍珠粉用量太大,生成CO2气体的体积超过注射器容量限制,则无法测量;
(3)为使药品混合,可以将装置向左倾斜,是盐酸流入左边关管内,故填:将异型装置向左倾斜,使稀盐酸流入左边管内;
(4)设计此实验装置,有利于测量生成的二氧化碳的体积,故填:方便操作和测量气体的体积.
【探究二】(1)若装置气密性良好,则当将注射器活塞拉上再松开的时候,活塞会重新回到原来的位置,故填:松开注射器活塞,活塞重新回到10mL刻度处;
(4)注射器读数为220mL,则生成的二氧化碳的质量为:0.22L×2g/L=0.44g,设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.44g
| 100 |
| x |
| 44 |
| 0.44g |
则该珍珠粉中碳酸钙的质量分数为:
| 1g |
| 1.1g |
故填:90.9%;
【实验反思】(1)此实验的原理是利用碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)如果产生的二氧化碳的体积超过了注射器的测量范围,则无法进行测定,故样品的质量需要控制,故填:需要,若珍珠粉用量太大,生成CO2气体的体积超过注射器容量限制,则无法测量;
(3)为使药品混合,可以将装置向左倾斜,是盐酸流入左边关管内,故填:将异型装置向左倾斜,使稀盐酸流入左边管内;
(4)设计此实验装置,有利于测量生成的二氧化碳的体积,故填:方便操作和测量气体的体积.
点评:本题为实验探究题,完成此题,可以依据已有的物质的性质结合物质间反应的现象进行.书写反应的化学方程式要注意配平.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

