题目内容
【题目】如图是A、B、C三种固体物质的溶解度曲线。
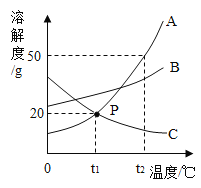
(1)点P表示______。
(2)当温度为t2℃时,A、B、C三种物质的溶解度由大到小的顺序______。
(3)要使接近饱和的C物质溶液变为饱和溶液,可采取的一种措施是______。
(4)t2℃时,A物质的饱和溶液150g降温到t1℃析出A物质______g(不含结晶水)。
(5)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为______。
(6)当A中含有少量B时,为了得到纯净的A,可采用_______的方法。
【答案】t1℃时,A、C的溶解度都为20g A>B>C 向溶液中加入物质C或升高溶液的温度 30 B>A>C 降温结晶
【解析】
(1)两种物质的溶解度曲线相交于一点,交点的含义是相应的温度下,两种物质的溶解度相同,所以图中点P表示t1℃时,A、C的溶解度相同,都为20g,故填t1℃时,A、C的溶解度都为20g。
(2)同一温度下,物质的溶解度曲线越高,则物质的溶解度越大,由图可知,温度为t2℃时,A、B、C三种物质的溶解度由大到小的顺序是A>B>C,故填A>B>C。
(3)由图可知,物质C的溶解度随温度升高而减小,所以使接近饱和的C物质溶液变为饱和溶液的方法除向溶液中加入物质C外,还可以升高C溶液的温度,使C的溶解度变小进而使溶液变为饱和溶液,故填向溶液中加入物质C或升高溶液的温度。
(4)由图可知,t2℃时,A物质的溶解度是50g,即t2℃时50gA恰好溶解在100g水中形成150g饱和溶液,t1℃时A的溶解度为20g,即t1℃时,20gA溶解在100g水中恰好形成饱和溶液,所以t2℃时,A物质的饱和溶液150g降温到t1℃析出A物质的质量=50g20g=30g,故填30。
(5)由图可知,物质A、B的溶解度都随温度升高而减小,且t1℃B的溶解度大于A的溶解度,所以将t2℃时A、B的饱和溶液降温到t1℃时,两种物质的溶解度均变小,得到的溶液均为饱和溶液,此时B溶液的溶质质量分数>A溶液的溶质质量分数,由图可知,物质C的溶解度随温度升高而减小,且t2℃时C的溶解度小于t1℃时A的溶解度,所以将t2℃时C物质的饱和溶液降温到t1℃时,C的溶解度增大,溶液由饱和状态变为不饱和状态,溶液的溶质质量分数不变,得到的C溶液的溶质质量分数<A溶液的溶质质量分数,即将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为B>A>C,故填B>A>C。
(6)由图可知,A、B两种物质的溶解度都随温度升高而增大,且A的溶解度受温度影响较大,所以当A中含有少量B时,为了使A从溶液中结晶析出得到纯净的A的方法是降温结晶,故填降温结晶。

【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的是( )
编号 | ① | ② | ③ | ④ |
实验设计 |
|
|
|
|
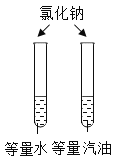
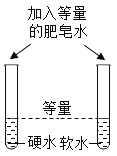
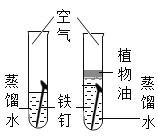
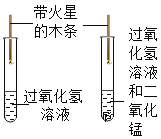
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 区分硬水和软水 | 探究铁生锈的条件 | 研究二氧化锰的催化作用 |
A.①B.②C.③D.④
【题目】化学学科实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成,让同学们设计实验进行探究。
(提出问题)固体样品的成分是什么?
(查阅资料)(1)碱石灰干燥剂是CaO和NaOH的混合物。
(2)BaCl2溶液显中性。
(猜想与假设)固体样品中可能含有 Fe、Fe2O3、CaO、NaOH、Ca(OH)2、Na2CO3和_____等七种物质。
(进行实验)
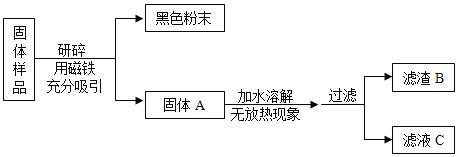
甲组同学对滤渣B的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 | ①_____________________ ②____________________ | 结论:滤渣B中的Fe2O3,CaCO3。盐酸和Fe2O3反应的化学方程式为:_________ |
乙组同学对滤液C的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论 |
取少量滤液C于试管中,加入过量BaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 | 有白色沉淀生成 酚酞试液由无色变成红色 | 滤液C中有___________ |
(1)乙组同学实验中加入过量BaCl2 溶液的目的是_____。
(2)通过以上实验探究,该固体样品中能确定一定含有的成分是_____。