题目内容
(3分)研究性学习小组为了测定黄铜(铜、锌合金)的组成,用电子天平分别称得锥形瓶与棉花的质量为44.1g,称取黄铜样品20.0g。在锥形瓶中加入该样品和足量稀硫酸后瓶口塞上棉花,如图1所示。将电子天平称量的数据绘成下图2。
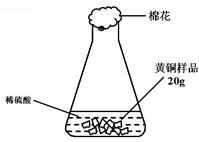
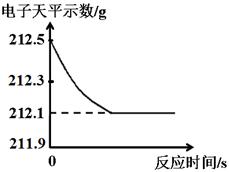
图1 图2
请认真分析数据,回答下列问题:
(1)四个同学从多角度处理数据,下列数据处理的图像中正确的是 。
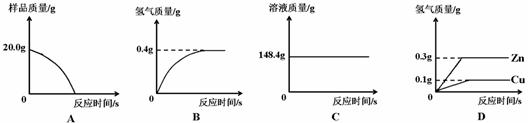
(2)试计算:
①样品中铜的质量分数;
②恰好反应时所得溶液中生成物的质量分数。


图1 图2
请认真分析数据,回答下列问题:
(1)四个同学从多角度处理数据,下列数据处理的图像中正确的是 。

(2)试计算:
①样品中铜的质量分数;
②恰好反应时所得溶液中生成物的质量分数。
(1)B (2)35%, 20%
试题分析:(1)根据具体的反应分析比较。
A、因为铜不与稀硫酸反应,黄铜中只有锌与稀硫酸反应,所以完全反应后,样品有剩余(铜),故A错误;
B、根据质量守恒定律可得,完全反应时生成氢气的质量为:212.5g-212.1g=0.4g,故B正确;
C、因为锌与稀硫酸反应过程中有气体生成,生成气体质量小于参与反应的锌的质量,故溶液质量会随着反应的进行而逐渐增加,到反应完全时不再变化,故C错误;
D、因为铜不与稀硫酸反应,黄铜中只有锌与稀硫酸反应,故D错误。故选B。
(2)利用锌与硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出样品中锌的质量和生成的硫酸锌的质量;①样品中铜的质量=样品质量-样品中锌的质量;然后根据“
 ×100%”计算即可;②所得溶液中生成物的溶质质量即生成的硫酸锌的质量,溶液质量=完全反应后电子天平示数-锥形瓶与棉花的质量-铜的质量;然后根据溶质质量分数公式计算即可。
×100%”计算即可;②所得溶液中生成物的溶质质量即生成的硫酸锌的质量,溶液质量=完全反应后电子天平示数-锥形瓶与棉花的质量-铜的质量;然后根据溶质质量分数公式计算即可。①设样品中锌的质量为x,生成的硫酸锌的质量为y
Zn + H2SO4 = ZnSO4 + H2↑
65 161 2
X y 0.4g
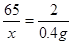
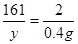
解之得,X=13g y=32.2g
则Cu的质量分数为

②所得溶液中生成物的溶质质量分数为
 ×100%=20%
×100%=20%答:样品中铜的质量分数为35%,反应后所得溶液中硫酸锌的质量分数为20%。
点评:本题主要考查学生的综合分析能力,判断数据处理的图象的正误要依据物质间反应的情况和图示数据分析;计算时要根据已知条件和化学方程式中的固定质量比,以及质量分数公式进行分析解答。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 Mg + Cl2↑。某工厂要生产出120 t金属镁,至少需要电解氯化镁多少吨?
Mg + Cl2↑。某工厂要生产出120 t金属镁,至少需要电解氯化镁多少吨?