题目内容
【题目】实验室保存有一瓶淡黄色固体药品,标签上的药品名称为“过氧化钠(Na2O2)”,但是已经过了保质期。某化学兴趣小组想知道这瓶固体究竟含有哪些物质。他们在老师的指导下进行了实验探究,请你完成兴趣小组的下列实验报告。
(查阅资料)
Ⅰ.过氧化钠是一种淡黄色固体,常用在呼吸面具和潜艇中制造氧气。其原理是:2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O═4NaOH+O2↑
Ⅱ.常温常压下,O2和CO2的密度分别为1.3g/L、1.8g/L。
(分析猜想)
(1)该小组同学认为,不用做实验,仅由查得的资料和所学知识就可推断该固体一定含有Na2O2.理由是_____。
(2)进一步对固体成分提出以下猜想:
Ⅰ.只有Na2O2;Ⅱ.含有Na2O2和Na2CO3两种物质;
Ⅲ.含有_____两种物质;Ⅳ.含有_____。
(实验操作)
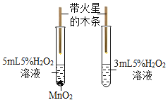
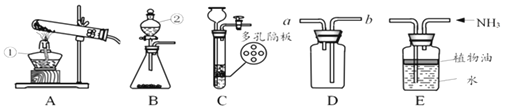
首先按如图连接好装置。用电子秤称取 1.00g 固体样品置于干燥的仪器 X 中,向分液漏斗中加入一定量的蒸馏水。
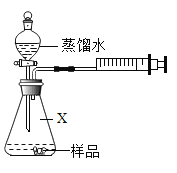
(3)仪器X的名称是_____。打开分液漏斗活塞,将蒸馏水加入仪器X中。反应完全后(无固体剩余),注射器内收集到80.0mL气体,说明样品中含有_____g Na2O2(计算结果保留到小数点后两位)。
(4)更换注射器后,再通过分液漏斗向仪器X 中加入足量稀盐酸,溶液中出现气泡,最终注射器内收集气体的质量为 0.11g。由此可知,样品中含有_____,该物质的质量为_____(计算结果保留到小数点后两位)。
(得出结论)
(5)通过以上实验操作得出结论,猜想_____是正确的(填序号)。
【答案】过氧化钠是淡黄色固体,而氢氧化钠和碳酸钠都是白色固体 Na2O2、NaOH; Na2O2、NaOH、Na2CO3 锥形瓶; 0.51。 碳酸钠; 0.27g Ⅳ
【解析】
(1)不要做实验,仅由查得的资料和所学知识就可推断该固体一定含有Na2O2,理由是过氧化钠是淡黄色固体,而氢氧化钠和碳酸钠都是白色固体;
(2)根据“2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O═4NaOH+O2↑”和质量守恒定律,进一步对固体成分提出以下猜想:
Ⅰ.只有Na2O2;
Ⅱ.含有Na2O2和Na2CO3两种物质;
Ⅲ.含有Na2O2、NaOH两种物质;
Ⅳ.含有Na2O2、NaOH、Na2CO3。
(3)仪器X的名称是锥形瓶;
反应完全后(无固体剩余),注射器内收集到80.0mL气体,该气体是氧气,氧气质量为:1.3g/L×0.08L=0.104g,
设:过氧化钠的质量为x。

![]() x=0.51g;
x=0.51g;
(4)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,再通过分液漏斗向仪器锥形瓶加入足量稀盐酸,溶液中出现气泡,说明样品中含有碳酸钠;最终注射器内收集气体的质量为0.11g,即碳酸钠和稀盐酸反应生成了0.11g二氧化碳,
设:碳酸钠质量为y。
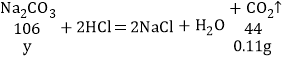
![]() y=0.27g;
y=0.27g;
(5)药品中含有氢氧化钠质量为:1.00g﹣0.51g﹣0.27g=0.22g,即药品中含有过氧化钠、氢氧化钠、碳酸钠,猜想Ⅳ是正确的。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
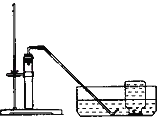
名校名卷单元同步训练测试题系列答案【题目】小明参观某养鱼池时,发现农民向养鱼池中撒一种叫做过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
(提出问题)过氧化钙可否用于制取氧气?
(查阅资料)部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解成氧气,可做增氧剂、杀菌剂等。
(猜想与论证)
(1)小明依据_____,提出猜想Ⅰ。
(猜想Ⅰ)加热过氧化钙可制取氧气。
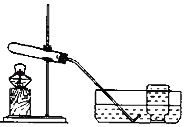
实验装置 | 实验主要过程 |
| ①检验装置气密性。操作如下:想将导管伸入液面下,用手紧握试管,观察到_____,松开后,有液体进入导管。 ②加入过氧化钙,加热,导管口有大量气泡冒出。 ③收集一瓶气体。 ④停止加热。熄灭酒精灯前,应_____。 ⑤检验气体。方法是_____。 |
(实验结论)加热过氧化钙可制取氧气。
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ。
(猜想Ⅱ)过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检验装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎看不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
(实验结论)不能用过氧化钙与水反应制取氧气,原因是_____。
(分析与反思)
①虽然没有快速收集到大量氧气,但由此实验现象,小明认为农民用过氧化钙做增氧剂的主要原因是_____。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?你的合理建议:_____。