题目内容
某粗盐样品中含有杂质氯化镁,氯化钙.某同学设计了以下提纯方案: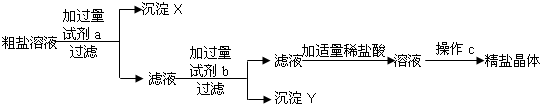
(1)若方案中先除去的是氯化镁,接着除去氯化钙,请回答:
①试剂a的化学式是
②指出操作c的名称
③操作过程中加适量稀盐酸时,发生的化学反应方程式是
(2)若所取粗盐样品中实际含氯化钠的质量为mg,除杂后所得精盐的质量为ng,则m

(1)若方案中先除去的是氯化镁,接着除去氯化钙,请回答:
①试剂a的化学式是
NaOH
NaOH
.b的化学式是Na2CO3
Na2CO3
.②指出操作c的名称
蒸发
蒸发
.③操作过程中加适量稀盐酸时,发生的化学反应方程式是
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
,Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
.(以上两个反应按先后顺序)(2)若所取粗盐样品中实际含氯化钠的质量为mg,除杂后所得精盐的质量为ng,则m
小于
小于
n(填“大于”“小于”或“等于”).理由是除杂过程中有新生成的NaCl
除杂过程中有新生成的NaCl
.分析:(1)①根据除去杂质不能引入新的杂质,并结合反应流程进行分析;
②根据溶液变成晶体的操作进行分析;
③根据反应物、生成物以及反应原理书写方程式;
(2)根据反应后溶液的成分,以及反应流程中发生的化学反应进行分析.
②根据溶液变成晶体的操作进行分析;
③根据反应物、生成物以及反应原理书写方程式;
(2)根据反应后溶液的成分,以及反应流程中发生的化学反应进行分析.
解答:解:(1)①除去杂质实际是除去杂质的离子,除杂质不能引入新的杂质,镁离子和钙离子是杂质的离子,要将镁离子沉淀可用氢氧根离子,要将钙离子沉淀可用碳酸根离子,故试剂a为NaOH,试剂b为Na2CO3;
②氯化钠的溶解度受温度影响变化较小,需要蒸发溶剂才能析出晶体,故操作c为蒸发;
③加入的氢氧化钠和碳酸钠都是过量的,滤液中有反应剩余的氢氧化钠和碳酸钠与盐酸反应,生成氯化钠、水、二氧化碳,反应方程式分别为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)最后的精盐中包括了过量的氢氧化钠、碳酸钠和盐酸反应生成的氯化钠,所以m<n;
故答案为:
(1)①NaOH;Na2CO3;②蒸发;NaOH+HCl=NaCl+H2O; Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)小于;除杂过程中有新生成的NaCl.
②氯化钠的溶解度受温度影响变化较小,需要蒸发溶剂才能析出晶体,故操作c为蒸发;
③加入的氢氧化钠和碳酸钠都是过量的,滤液中有反应剩余的氢氧化钠和碳酸钠与盐酸反应,生成氯化钠、水、二氧化碳,反应方程式分别为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)最后的精盐中包括了过量的氢氧化钠、碳酸钠和盐酸反应生成的氯化钠,所以m<n;
故答案为:
(1)①NaOH;Na2CO3;②蒸发;NaOH+HCl=NaCl+H2O; Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)小于;除杂过程中有新生成的NaCl.
点评:本题主要考查了粗盐提纯实验的相关的操作要领以及物质除杂的原则,要结合反应流程图、物质的性质细心分析解答.

练习册系列答案
相关题目





