题目内容
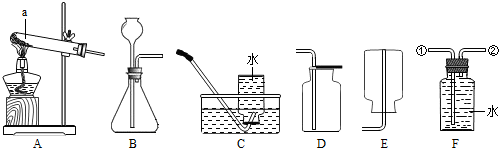
(2012?天津)某粗盐样品中含有杂质氯化镁、氯化钙.某同学设计了以下提纯方案:

请回答下列问题:
(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去粗盐中的
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是
(3)滤液B中所含的溶质为
(4)向滤液B滴加稀盐酸的过程中,当观察到的溶液的现象为
(5)操作C的名称为
(6)工业上用电解饱和食盐水的方法可制取氢氧化钠、氢气、和氯气,写出反应的化学方程式

请回答下列问题:
(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去粗盐中的
氯化镁
氯化镁
.(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是
漏斗
漏斗
.(3)滤液B中所含的溶质为
氯化钠、氢氧化钠,碳酸钠
氯化钠、氢氧化钠,碳酸钠
.(4)向滤液B滴加稀盐酸的过程中,当观察到的溶液的现象为
无气泡放出
无气泡放出
时,应停止滴加,如果滴加的稀盐酸过量,对最后得到的精盐晶体的成分没有
没有
(填“有”或“没有”)影响.(5)操作C的名称为
蒸发
蒸发
.(6)工业上用电解饱和食盐水的方法可制取氢氧化钠、氢气、和氯气,写出反应的化学方程式
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
| ||
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
.
| ||
分析:(1)根据氢氧化钠会和哪种杂质反应生成沉淀进行分析;
(2)过滤实验中要用到的仪器有:漏斗、铁架台、烧杯、玻璃棒;
(3)根据前面几步所加的试剂的过量程度以及反应后的溶质进行分析;
(4)向滤液B滴加稀盐酸当观察到溶液中无气泡放出时,停止滴加;过量的稀盐酸对最后得到的精盐晶体的成分没有影响;
(5)得到精盐晶体之前的操作是蒸发.
(6)该反应的反应物为氯化钠与水,生成物为氢氧化钠、氢气和氯气,反应条件为通电,故可书写此化学方程式.
(2)过滤实验中要用到的仪器有:漏斗、铁架台、烧杯、玻璃棒;
(3)根据前面几步所加的试剂的过量程度以及反应后的溶质进行分析;
(4)向滤液B滴加稀盐酸当观察到溶液中无气泡放出时,停止滴加;过量的稀盐酸对最后得到的精盐晶体的成分没有影响;
(5)得到精盐晶体之前的操作是蒸发.
(6)该反应的反应物为氯化钠与水,生成物为氢氧化钠、氢气和氯气,反应条件为通电,故可书写此化学方程式.
解答:解:(1)因为钠盐都溶于水,而氢氧根离子会将镁离子转化为氢氧化镁沉淀,剩余氯化钠.
故答案为:氯化镁.
(2)过滤实验中要用到的仪器有:漏斗、铁架台、烧杯、玻璃棒.
故答案为:漏斗.
(3)前面的除杂各步后都剩下氯化钠,但是在除杂时加入的氢氧化钠和碳酸钠(除去氯化钙时,用过量的碳酸钠,即过量的试剂b)都是过量的.
故答案为:氯化钠、氢氧化钠,碳酸钠.
(4)向滤液B滴加稀盐酸当观察到溶液中无气泡放出时,停止滴加,防止稀盐酸过量;过量的稀盐酸对最后得到的精盐晶体的成分没有影响,因为稀盐酸不与氯化钠反应;
故答案为:无气泡放出;没有.
(5)得到精盐晶体之前的操作是蒸发.
故答案为:蒸发.
(6)由分析可知,反应物、生成物、反应条件;故可书写此化学方程式为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑
故答为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑.
故答案为:氯化镁.
(2)过滤实验中要用到的仪器有:漏斗、铁架台、烧杯、玻璃棒.
故答案为:漏斗.
(3)前面的除杂各步后都剩下氯化钠,但是在除杂时加入的氢氧化钠和碳酸钠(除去氯化钙时,用过量的碳酸钠,即过量的试剂b)都是过量的.
故答案为:氯化钠、氢氧化钠,碳酸钠.
(4)向滤液B滴加稀盐酸当观察到溶液中无气泡放出时,停止滴加,防止稀盐酸过量;过量的稀盐酸对最后得到的精盐晶体的成分没有影响,因为稀盐酸不与氯化钠反应;
故答案为:无气泡放出;没有.
(5)得到精盐晶体之前的操作是蒸发.
故答案为:蒸发.
(6)由分析可知,反应物、生成物、反应条件;故可书写此化学方程式为:2NaCl+2H2O
| ||
故答为:2NaCl+2H2O
| ||
点评:本题主要对物质的除杂和净化进行了探究,在除杂质的同时不要引入新的杂质.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
 (2012?天津)某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥,过程如图所示,其中试剂甲和乙可能是( )
(2012?天津)某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥,过程如图所示,其中试剂甲和乙可能是( )