题目内容
【题目】根据下列实验装置图,回答有关问题。
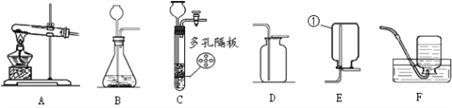
﹙1﹚图中标有①的仪器名称是________ 。
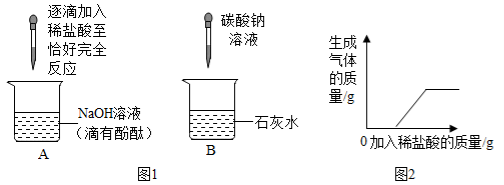
﹙2﹚实验室加热氯酸钾和二氧化锰制取氧气的化学方程式为______其中二氧化锰起________作用,应选用的发生装置是________(填字母),若用F装置收集氧气,当导管口气泡_______放出时,再把导管口伸入盛满水的集气瓶。
﹙3﹚实验室用锌粒和稀硫酸制取氢气,反应的化学方程式为_______若用排空气法收集氢气,应选用的收集装置是_____(填字母)。与B装置比较,选用C装置做发生装置的优点是_________。
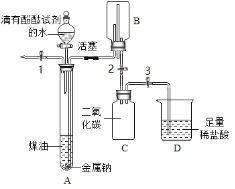
﹙4﹚已知:钠在常温下与水剧烈反应生成氢气和氢氧化钠。小明结合已有知识设计下图装置进行验证,他的操作如下:①打开止水夹1及分液漏斗活塞,待液体充满大试管后,关闭止水夹1及分液漏斗活塞。观察到液体分层,钠熔成银白色小球,产生大量气泡,下层溶液变成红色,并逐渐被压入B中。②打开止水夹2,待B中部分溶液进入C中,迅速关闭止水夹2,C 中反应的化学方程式为_______。③打开止水夹 3,D中溶液进入 C 中,产生气泡,溶液红色消失。反应结束,C中溶液的溶质是(酚酞除外,写出所有可能) _________。④将燃着的木条伸到导管尖嘴处,打开止水夹1,气体燃烧,产生__________色火焰。
【答案】 集气瓶 ![]() 催化 A 连续并比较均匀
催化 A 连续并比较均匀 ![]() E 控制反应的发生和停止
E 控制反应的发生和停止 ![]() NaCl ,NaCl和HCl 淡蓝色
NaCl ,NaCl和HCl 淡蓝色
【解析】本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择。
(1)图中标有①的仪器名称是集气瓶;
(2)氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑,二氧化锰是该反应的催化剂,起催化作用,该反应的反应物是固体,反应条件是加热,应选用的发生装置是A,用F装置收集氧气,当导管口气泡连续均匀放出时,再把导管口伸入盛满水的集气瓶;
2KCl+3O2↑,二氧化锰是该反应的催化剂,起催化作用,该反应的反应物是固体,反应条件是加热,应选用的发生装置是A,用F装置收集氧气,当导管口气泡连续均匀放出时,再把导管口伸入盛满水的集气瓶;
(3)锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑,氢气的密度比空气小,所以用排空气法收集氢气,应选用的收集装置是E,C装置可以通过装置内压强的改变实现固体和液体的分离,从而使反应停止,所以与B装置比较,选用C装置的优点是:可以控制反应的发生和停止;
(4)②二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为:CO2+2NaOH═Na2CO3+H2O;③C中是碳酸钠和稀盐酸反应,若二者完全反应,溶质只有氯化钠,若不完全反应,可能剩余盐酸,但没有碳酸钠,因为看到红色消失,溶液不显碱性,所以C中溶液的溶质是:NaCl或NaCl和HCl;
④氢气和氧气在点燃的条件下生成水,所以将燃着的木条伸到导管尖嘴处,打开止水夹1,气体燃烧,产生淡蓝色火焰。

【题目】臭氧(O3)是对于环境有重要影响的物质,兴趣小组对其进行如下探究。
【查阅资料】①O3微溶于水:
②O3常用于消毒等,但浓度超标时对人体有毒副作用;
③品红溶液为红色,遇强氧化剂(如O3)会变味无色。
探究一·臭氧的制备
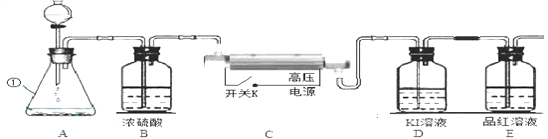
(1)写出仪器①名称___________。
(2)图中A装置制取氧气的化学方程式是______________。
(3)将A中制得的氧气一次通过图中B→E装置。
①B中浓硫酸的作用是____________________。
②实验开始,先通过一段时间氧气,合上C装置电源开关,在电火花作用下O2会转化为O3,该反应是____(填“物理”或“化学”)变化。
探究二·臭氧含量的测定
D中反应原理为:2KI+O3+H2O 2KOH+I2+O2,当E中出现现象时,可知D中反应完全。从安全、环保角度看,上述装置不足之处是____________。
(6)若D中生成碘12.7mg,则理论上应吸收O3_______mg(O3、I2的相对分子质量分别为48.254)。
探究三·影响臭氧分解的因素
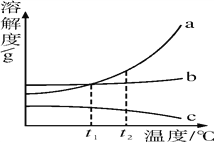
O3在水中易分解,一定条件下,某浓度的O3在浓度减少一半所需的时间(t)如下表所示。
温度 分钟 pH | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
40 | 31 | 26 | 15 | 7 |
(7)①分析表中数据,臭氧的分解速率与___________、___________有关。
②据表推测O3在下列条件下分解速率从小到大的顺序为___________(填序号)。
a.20℃、pH=3.0 b.30℃、pH=4.0 c.50℃、pH=6.0
③臭氧在水中分解是臭氧与水反应生成氧气和过氧化氢,反应的化学方程式为__________。