题目内容
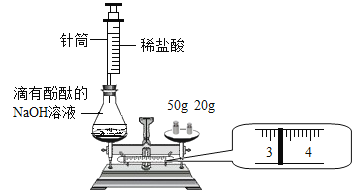
【题目】25g大理石和100g稀盐酸溶液恰好完全反应(杂质不与酸反应),反应结束后,称得烧杯内物质的质量为116.2 g,求:
(1)反应中生成CO2的质量_____;
(2)该大理石中CaCO3的质量分数_____。
【答案】8.8g 80%
【解析】
根据碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;根据质量守恒定律,试管中质量的减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出生成的碳酸钙的质量,进而计算出石灰石中含碳酸钙的质量分数.
(1)由质量守恒定律,生成二氧化碳气体的质量为25g+100g-116.2g=8.8g.
(2)设原石灰石中CaCO3的质量为x
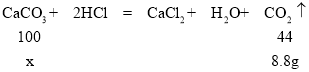
![]()
x=20g
该大理石中CaCO3的质量分数:![]()

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目