题目内容
【题目】盐酸、硫酸、氢氧化钠、氢氧化钙是最常见的酸和碱。
(1)写出氢氧化钠的一种俗名_____,写出盐酸的一种用途_____。
(2)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?_____
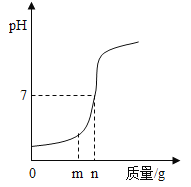
(3)用熟石灰中和一定量的盐酸时,溶液的pH与加入熟石灰质量的关系如下图所示。熟石灰与盐酸反应的化学方程式为_____;当加入熟石灰mg时,溶液中的溶质为_____。
(4)某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。向该溶液中滴加盐酸时,发现有气泡产生,请用两个化学方程式解释其原因。_____
(5)某工厂利用废铁屑与废硫酸起反应来制取琉酸亚铁。现有废硫酸196t(H2SO4的质量分数为10%),与足量废铁屑起反应,可生产硫酸亚铁的质量是________。
【答案】 火碱、烧碱或苛性钠 除铁锈或人的胃液中帮助消化 因为浓盐酸具有挥发性,打开瓶盖,瓶口会出现白雾 2HCl+Ca(OH)2=CaCl2+2H2O CaCl2、HCl或者氯化钙、氯化氢 2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑ 30.4 t
【解析】本题考查了常见的酸和碱性质和有关化学方程式的计算。
(1)氢氧化钠的俗名为火碱、烧碱或苛性钠;盐酸用途有除铁锈或人的胃液中帮助消化等;
(2)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,由于浓盐酸具有挥发性,打开瓶盖,瓶口会出现白雾,所以立即就能把它们区分开来。
(3)熟石灰与盐酸反应时氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为 2HCl+Ca(OH)2=CaCl2+2H2O;当加入熟石灰mg时,此时溶液显酸性,所以溶液中的溶质为有生成的氯化钙和剩余的氯化氢(或CaCl2、HCl);
(4)某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖,发生变质,是氢氧化钠和二氧化碳反应生成碳酸钠和水,向该溶液中滴加盐酸时,发现有气泡产生,是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑
(5)废硫酸含硫酸的质量为196t×10%=19.6t
设硫酸亚铁的质量为x
Fe+H2SO4═FeSO4+H2↑
98 152
19.6t x
![]() x=30.4t。
x=30.4t。

【题目】有一种神奇的蜡烛,任你怎么吹也吹不灭,而且看上去和普通的蜡烛一模一样,那么到底是什么能让蜡烛持续燃烧?请你一起参与探究。
【查阅资料】普通蜡烛由石蜡和蜡烛芯制成,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末,打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃,当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。
【请教老师】老师告诉同学们,蜡烛芯内打火石中的某种金属是镁、铁、铜三种金属中的一种。
【进行实验】为确定该金属的成分,大家设计了以下实验方案。
实验操作步骤 | 实验现象 | 实验结论 |
1.切开蜡烛,取出打火石,用砂纸打磨 | 打火石呈银白色 | 该金属一定不是________ |
2.取少量打磨后的打火石于试管中,滴加稀盐酸 | 有无色气体产生,反应后的溶液呈______色 | 该金属一定不是铁,而是镁 |
【反思交流】(1)实验2中反应的化学方程式为__________________________________。
(2)这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?___________________________;当吹灭蜡烛时,烛芯中的金属燃烧的化学方程式为_________________________________。
(3)这种“吹不灭”的蜡烛实际上也可以熄灭,你采用的方法是______。