题目内容
【题目】现有甲、乙两种金属分别与相同质量分数的稀盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列说法正确的是( )
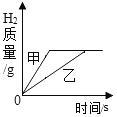
A.金属甲的活动性小于金属乙
B.反应完全后消耗两种金属的质量相同
C.因为生成气体,故反应后两溶液的质量均减小
D.反应完全后消耗稀盐酸的质量相同
【答案】D
【解析】
A、根据反应的时间进行分析;
B、根据金属与酸的反应分析;
C、根据质量守恒定律进行分析;
D.根据生成的氢气质量相同进行分析。
A、由图象可知,甲反应的时间短,反应的速率快,金属甲的活动性大于乙,不符合题意;
B、甲乙是两种不同的金属,当生成的氢气质量相同时,根据化学方程式计算,反应完全后消耗两种金属的质量不相同,不符合题意;
C、由于金属参加了反应,虽然生成气体,但反应后两溶液的质量均增加,不符合题意;
D、通过图象可以看出,生成的氢气质量相同,根据化学方程式计算,反应完全后消耗稀盐酸的质量相同,符合题意。故选D。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】小英同学为了测定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75mL的稀盐酸分三次加入石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:
实验 | 第一次 | 第二次 | 第三次 |
加入稀盐酸的量/mL | 25 | 25 | 25 |
生成气体的质量/g | 2.2 | m | 1.1 |
试求:
(1)m的值是 g.
(2)求该样品中碳酸钙的质量分数(保留一位小数).
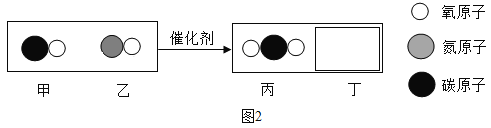
【题目】可燃物R是C、H2、CH4、CO或CH4O中的一种。将一定量的R和氧气置于一个密闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | R | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | m1 | m2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | m3 | m4 | m5 |
下列叙述正确的是( )
①m1=1/9m4时,R是H2
②m1+m2=m3时,R是C或CO
③ m3:m4=11:9时,R是CH4或CH4O
④8m3/11+8m4/9+4m5/7≥m2
A. ①②③ B. ①③④ C. ②③④ D. ①②③④