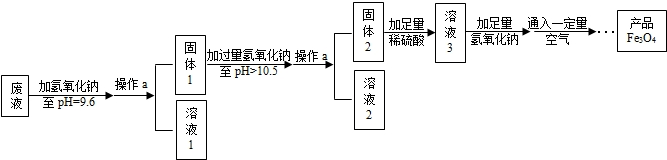
��Ŀ����
��2013?���ݣ���ͼ1��ʾ�����������ġ�С���ѡ���������Χ��һȦ����Ϸ����Ϊ�ᣬ��Ϊ���Ϊ���ָʾ�����ס��ҡ�����
��Ϊ��ͬ�������ʣ���������ɷ��ࣩ����Ϸ����ֻҪ���ڵ������ܷ�Ӧ����Ϸ���ܽ�����ȥ��
��1��д���ܴ������붡��Ӧ��һ����ѧ����ʽ
��2��������Ϸ�����ҿ�����
��3��������Ϸ����ͼ2��ѡ���������ʣ�����������ͼ3�����ϣ�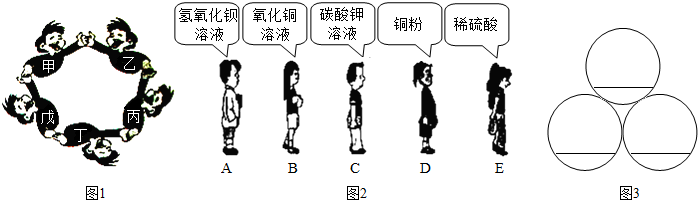
��Ϊ��ͬ�������ʣ���������ɷ��ࣩ����Ϸ����ֻҪ���ڵ������ܷ�Ӧ����Ϸ���ܽ�����ȥ��
��1��д���ܴ������붡��Ӧ��һ����ѧ����ʽ
HCl+NaOH=NaCl+H2O
HCl+NaOH=NaCl+H2O
���������Ӧ���������ֽ�
���ֽ�
��Ӧ����2��������Ϸ�����ҿ�����
�������������ɣ�
�������������ɣ�
����������𣩣�д���ܴ����������Ӧ��һ����ѧ����ʽFe+CuSO4=FeSO4+Cu���������ɣ�
Fe+CuSO4=FeSO4+Cu���������ɣ�
����3��������Ϸ����ͼ2��ѡ���������ʣ�����������ͼ3�����ϣ�

�������������ʼ�ķ�Ӧ�������������������λ�������������������λ�ǽ���������ݴ˷�����ɣ�
����⣺��1���������ܹ������кͷ�Ӧ�����Կ�����д��صķ���ʽ����HCl+NaOH=NaCl+H2O���÷�Ӧ�������ֻ�����������ɷ��������ֻ�����ĸ��ֽⷴӦ��
��2�����ڼ�Ϊ�ᣬ��Ϊ���Ϊ���ָʾ�������ܹ����ҷ�Ӧ�����ҿ����ǽ����������ҿ���������Һ��Ӧ���ο����붡�Ӧ�����������Ӧ�ķ���ʽ����Ϊ��Fe+CuSO4=FeSO4+Cu���������ɣ���
��3���������ڵ����ʼ���Է�����Ӧ�������ø��ֽⷴӦ�ķ���������֪��A��������������C̼��ط�Ӧ��Eϡ���ᷴӦ����̼��غ�ϡ����Ҳ���Է�Ӧ���ʶ����Ͽ�����ACE�������ʣ�˳���ޣ���
�ʴ�Ϊ����1��HCl+NaOH=NaCl+H2O���������ɣ������ֽ⣻
��2���������������ɣ���Fe+CuSO4=FeSO4+Cu���������ɣ��� ��3��ACE��˳���ޣ���
��2�����ڼ�Ϊ�ᣬ��Ϊ���Ϊ���ָʾ�������ܹ����ҷ�Ӧ�����ҿ����ǽ����������ҿ���������Һ��Ӧ���ο����붡�Ӧ�����������Ӧ�ķ���ʽ����Ϊ��Fe+CuSO4=FeSO4+Cu���������ɣ���
��3���������ڵ����ʼ���Է�����Ӧ�������ø��ֽⷴӦ�ķ���������֪��A��������������C̼��ط�Ӧ��Eϡ���ᷴӦ����̼��غ�ϡ����Ҳ���Է�Ӧ���ʶ����Ͽ�����ACE�������ʣ�˳���ޣ���
�ʴ�Ϊ����1��HCl+NaOH=NaCl+H2O���������ɣ������ֽ⣻
��2���������������ɣ���Fe+CuSO4=FeSO4+Cu���������ɣ��� ��3��ACE��˳���ޣ���
�����������Ƕ����ʼ䷴Ӧ�Ŀ��飬����Ĺؼ���������ص����ʵ������Լ���Ӧ���ɣ�

��ϰ��ϵ�д�
 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�
�����Ŀ