题目内容
(2013?福州)四氧化三铁可用于医疗器械、电子等工业.某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验.
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表.
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液.
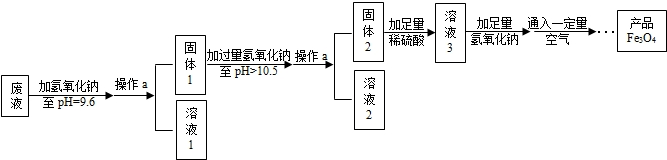
(3)制备Fe3O4的实验流程如图:
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为
(2)操作a的名称为
(3)溶液1所含溶质有
(4)该实验取废液100g,最终得到产品四氧化三铁质量为3.48g,则原废液中硫酸亚铁溶质的质量分数不低于
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表.
| Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀的pH | 5.7 | 7.6 | 10.4 |
| 沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(3)制备Fe3O4的实验流程如图:

【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为
2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4=Fe(OH)2↓+Na2SO4】
2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4=Fe(OH)2↓+Na2SO4】
(写一个即可).(2)操作a的名称为
过滤
过滤
.该操作需要的玻璃仪器有烧杯、玻璃棒、漏斗
漏斗
等.玻璃棒在此操作中的主要作用是引流
引流
.(3)溶液1所含溶质有
硫酸镁、硫酸钠
硫酸镁、硫酸钠
(至少写两种);溶液3所含溶质的主要成分为硫酸亚铁
硫酸亚铁
.(4)该实验取废液100g,最终得到产品四氧化三铁质量为3.48g,则原废液中硫酸亚铁溶质的质量分数不低于
6.84%
6.84%
(精确到0.01%).分析:(1)加入氢氧化钠溶液后,可以判断能形成得到氢氧化锌和氢氧化亚铁沉淀,可以据此写出反应的化学方程式;
(2)经过操作a后得到了固体和溶液,所以可以判断操作a的名称为过滤,过滤需要漏斗,玻璃棒在该过程中的作用为引流,可以据此解答该题;
(3)加入氢氧化钠后,硫酸锌和氢氧化钠反应生成了硫酸钠,氢氧化镁只有在pH值等于10.4时,才会沉淀,所以溶液中还含有硫酸镁,向固体1中加入氢氧化钠溶液,根据题给信息可以知道25℃时,Zn(OH)2可溶于pH>10.5的碱溶液,所以氢氧化锌要溶解,剩余的固体2为氢氧化亚铁,所以加入稀硫酸后溶液3的溶质为硫酸亚铁,可以据此解答该题;
(4)根据铁元素的质量守恒来完成该题的解答.
(2)经过操作a后得到了固体和溶液,所以可以判断操作a的名称为过滤,过滤需要漏斗,玻璃棒在该过程中的作用为引流,可以据此解答该题;
(3)加入氢氧化钠后,硫酸锌和氢氧化钠反应生成了硫酸钠,氢氧化镁只有在pH值等于10.4时,才会沉淀,所以溶液中还含有硫酸镁,向固体1中加入氢氧化钠溶液,根据题给信息可以知道25℃时,Zn(OH)2可溶于pH>10.5的碱溶液,所以氢氧化锌要溶解,剩余的固体2为氢氧化亚铁,所以加入稀硫酸后溶液3的溶质为硫酸亚铁,可以据此解答该题;
(4)根据铁元素的质量守恒来完成该题的解答.
解答:解:(1)加入氢氧化钠溶液后,可以判断能形成得到氢氧化锌和氢氧化亚铁沉淀,该反应的化学方程式为:2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4=Fe(OH)2↓+Na2SO4】;
(2)经过操作a后得到了固体和溶液,所以可以判断操作a的名称为过滤,过滤需要漏斗,玻璃棒在该过程中的作用为引流,;
(3)加入氢氧化钠后,硫酸锌和氢氧化钠反应生成了硫酸钠,氢氧化镁只有在pH值等于10.4时,才会沉淀,所以溶液中还含有硫酸镁,向固体1中加入氢氧化钠溶液,根据题给信息可以知道25℃时,Zn(OH)2可溶于pH>10.5的碱溶液,所以氢氧化锌要溶解,剩余的固体2为氢氧化亚铁,所以加入稀硫酸后溶液3的溶质为硫酸亚铁;
(4)3.48g四氧化三铁中铁元素的质量为:3.48g×
×100%=2.52g
所以硫酸亚铁的质量为:2.52g÷
×100%=6.84g
所以原废液中硫酸亚铁溶质的质量分数为:
×100%=6.84%
答:原废液中硫酸亚铁溶质的质量分数不低于6.84%.
故答案为:(1)2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4═Fe(OH)2↓+Na2SO4】;
(2)过滤、漏斗、引流;
(3)硫酸镁、硫酸钠;硫酸亚铁;
(4)6.84%.
(2)经过操作a后得到了固体和溶液,所以可以判断操作a的名称为过滤,过滤需要漏斗,玻璃棒在该过程中的作用为引流,;
(3)加入氢氧化钠后,硫酸锌和氢氧化钠反应生成了硫酸钠,氢氧化镁只有在pH值等于10.4时,才会沉淀,所以溶液中还含有硫酸镁,向固体1中加入氢氧化钠溶液,根据题给信息可以知道25℃时,Zn(OH)2可溶于pH>10.5的碱溶液,所以氢氧化锌要溶解,剩余的固体2为氢氧化亚铁,所以加入稀硫酸后溶液3的溶质为硫酸亚铁;
(4)3.48g四氧化三铁中铁元素的质量为:3.48g×
| 56×3 |
| 56×3+16×4 |
所以硫酸亚铁的质量为:2.52g÷
| 56 |
| 56+32+16×4 |
所以原废液中硫酸亚铁溶质的质量分数为:
| 6.84g |
| 100g |
答:原废液中硫酸亚铁溶质的质量分数不低于6.84%.
故答案为:(1)2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4═Fe(OH)2↓+Na2SO4】;
(2)过滤、漏斗、引流;
(3)硫酸镁、硫酸钠;硫酸亚铁;
(4)6.84%.
点评:要想解答好这类题目,首先,要理解和熟记物质的相互转化和制备方法,以及与之相关的知识.然后,根据所给的实验、问题情景,结合所学的相关知识和技能,以及自己的生产或生活经验所得,细致地分析题意,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目