题目内容
(2013?福州质检)某品牌纯碱中含有少量氯化钠.某化学探究小组为了测定该品牌纯碱的纯度(即碳酸钠的质量分数),组内一同学设计如图1所示实验:
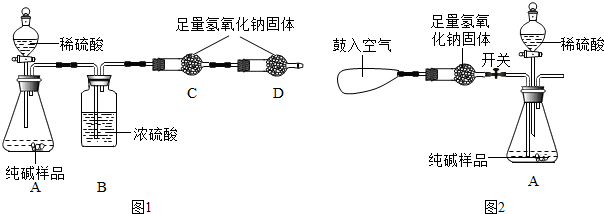
(1)A装置中反应的化学方程式为
(2)B装置的作用是
(3)D装置的作用是
(4)小明提出能否用盐酸代替硫酸?同学们经过讨论认为不能,理由是
(5)小华提出,要使测定结果更准确,应把A装置改成图2所示装置,并在反应前鼓入空气,其目的是
(6)称得纯碱样品的质量为12.0g,实验前、后C装置(包含药品)的质量分别为61.2g和65.6g,则该纯碱样品的纯度为

(1)A装置中反应的化学方程式为
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
.(2)B装置的作用是
除去水蒸气
除去水蒸气
;C装置中反应的化学方程式为2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.(3)D装置的作用是
防止空气中的二氧化碳、水蒸气进入C装置
防止空气中的二氧化碳、水蒸气进入C装置
.(4)小明提出能否用盐酸代替硫酸?同学们经过讨论认为不能,理由是
盐酸挥发出氯化氢气体被装置C吸收,影响实验测定
盐酸挥发出氯化氢气体被装置C吸收,影响实验测定
.(5)小华提出,要使测定结果更准确,应把A装置改成图2所示装置,并在反应前鼓入空气,其目的是
用不含二氧化碳的空气排出AB装置中原有的空气
用不含二氧化碳的空气排出AB装置中原有的空气
;反应后还要鼓入空气,其目的是使生成的二氧化碳全部鼓入C装置
使生成的二氧化碳全部鼓入C装置
.(6)称得纯碱样品的质量为12.0g,实验前、后C装置(包含药品)的质量分别为61.2g和65.6g,则该纯碱样品的纯度为
88.3
88.3
%(精确到0.1%).分析:(1)根据碳酸钠和硫酸反应原理书写方程式;
(2)根据浓硫酸具有吸水性,可作干燥剂分析解答,并据二氧化碳与氢氧化钠反应原理书写方程式;
(3)根据氢氧化钠固体的性质和D装置的作用考虑;
(4)根据盐酸的挥发性分析;
(5)图2中在反应前鼓入空气,可将通入的空气中的二氧化碳通过足量氢氧化钠固体除去,并排尽AB装置内含有二氧化碳的空气,使测定结果更准确;反应后鼓入空气是为了将反应生成的二氧化碳赶到C装置;
(6)根据C装置质量的增加量就是生成二氧化碳的质量,根据二氧化碳的质量算出碳酸钠的质量,再除以样品的质量乘以百分之百即可计算出样品中碳酸钠的质量分数.
(2)根据浓硫酸具有吸水性,可作干燥剂分析解答,并据二氧化碳与氢氧化钠反应原理书写方程式;
(3)根据氢氧化钠固体的性质和D装置的作用考虑;
(4)根据盐酸的挥发性分析;
(5)图2中在反应前鼓入空气,可将通入的空气中的二氧化碳通过足量氢氧化钠固体除去,并排尽AB装置内含有二氧化碳的空气,使测定结果更准确;反应后鼓入空气是为了将反应生成的二氧化碳赶到C装置;
(6)根据C装置质量的增加量就是生成二氧化碳的质量,根据二氧化碳的质量算出碳酸钠的质量,再除以样品的质量乘以百分之百即可计算出样品中碳酸钠的质量分数.
解答:解:(1)反应物是Na2CO3和H2SO4生成物是Na2SO4、H2O和CO2用观察法配平,二氧化碳后面标上上升符号,方程式是:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(2)浓硫酸具有吸水性,所以主要是除去二氧化碳中的水蒸气;C装置中反应的反应物是NaOH和CO2生成物是Na2CO3和H20,用观察法配平,方程式是:2NaOH+CO2=Na2CO3+H2O;
(3)D装置是防止空气中的水、二氧化碳进入C装置造成误差,因为氢氧化钠固体可与二氧化碳反应,且能吸收水分;
(4)稀盐酸若挥发出氯化氢气体,被C装置吸收,影响实验测定,故不用盐酸;
(5)鼓入的空气经过了氢氧化钠,已经把空气中二氧化碳除去,用不含二氧化碳的空气排出AB装置中原有的空气,由于原有的空气中含有二氧化碳;
反应后鼓入空气的目的是:用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体,使反应产生的二氧化碳全部被C装置吸收;
(6)C装置质量的增加量就是生成二氧化碳的质量,所以生成二氧化碳的质量为:65.6g-61.2g=4.4g
设要生成4.4g二氧化碳需要碳酸钠质量为x
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 4.4g
=
x=10.6g
所以纯碱的纯度为
×100%=88.3%;
故答案为:
(1)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)除去水蒸气; 2NaOH+CO2=Na2CO3+H2O;
(3)防止空气中的二氧化碳、水蒸气进入C装置;
(4)盐酸挥发出氯化氢气体被装置C吸收,影响实验测定;
(5)用不含二氧化碳的空气排出AB装置中原有的空气; 使生成的二氧化碳全部鼓入C装置;
(6)88.3.
(2)浓硫酸具有吸水性,所以主要是除去二氧化碳中的水蒸气;C装置中反应的反应物是NaOH和CO2生成物是Na2CO3和H20,用观察法配平,方程式是:2NaOH+CO2=Na2CO3+H2O;
(3)D装置是防止空气中的水、二氧化碳进入C装置造成误差,因为氢氧化钠固体可与二氧化碳反应,且能吸收水分;
(4)稀盐酸若挥发出氯化氢气体,被C装置吸收,影响实验测定,故不用盐酸;
(5)鼓入的空气经过了氢氧化钠,已经把空气中二氧化碳除去,用不含二氧化碳的空气排出AB装置中原有的空气,由于原有的空气中含有二氧化碳;
反应后鼓入空气的目的是:用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体,使反应产生的二氧化碳全部被C装置吸收;
(6)C装置质量的增加量就是生成二氧化碳的质量,所以生成二氧化碳的质量为:65.6g-61.2g=4.4g
设要生成4.4g二氧化碳需要碳酸钠质量为x
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
x=10.6g
所以纯碱的纯度为
| 10.6g |
| 12.0g |
故答案为:
(1)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)除去水蒸气; 2NaOH+CO2=Na2CO3+H2O;
(3)防止空气中的二氧化碳、水蒸气进入C装置;
(4)盐酸挥发出氯化氢气体被装置C吸收,影响实验测定;
(5)用不含二氧化碳的空气排出AB装置中原有的空气; 使生成的二氧化碳全部鼓入C装置;
(6)88.3.
点评:本题考查的知识比较全面,要认真分析装置的作用,并能根据物质的性质、质量守恒定律分析解答,较好考查学生分析解决问题的能力.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目