题目内容
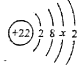
【题目】向16g黄铜(由锌、铜形成的合金)样品中,加入100g稀硫酸充分反应后,恰好完全反应,烧杯内物质的质量为115.6g。
⑴产生氢气的质量。
⑵计算黄铜中含铜的质量。
⑶计算稀硫酸的溶质的质量分数。
【答案】(1)0.4 ;(2)13g ;(3)19.6%
【解析】(1)⑴产生氢气的质量为:16g+100g-115.6=0.4g;(2)设 16g黄铜样品中锌的质量为![]() ,(3)设100g 稀硫酸中溶质的质量为 y
,(3)设100g 稀硫酸中溶质的质量为 y
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.4g
![]()
![]() =13g,y=19.6g
=13g,y=19.6g
(3)稀硫酸中溶质的质量分数为: ![]() .
.
答:产生氢气的质量为0.4g;黄铜样品中铜的质量为13g; 稀硫酸中溶质的质量分数为19.6%。

练习册系列答案
相关题目
【题目】乙醇不完全燃烧时产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,不正确的是( )
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A.表中的a值为1.4
B.生成的CO和CO2分子个数比为1:3
C.参加反应的乙醇和氧气的质量比为3:4
D.在化学反应前后碳元素质量一定相等