题目内容
【题目】乙醇不完全燃烧时产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,不正确的是( )
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A.表中的a值为1.4
B.生成的CO和CO2分子个数比为1:3
C.参加反应的乙醇和氧气的质量比为3:4
D.在化学反应前后碳元素质量一定相等
【答案】C
【解析】A、由各物质反应前后的质量变化可知,乙醇反应了4.6g,氧气反应了8.8g,生成了二氧化碳6.6g,生成的水的质量为5.4g,根据质量守恒定律化学反应前后物质的总质量不变,故a=4.6g+8.8g-6.6g-5.4g=1.4g,A不符合题意;
B、该反应的化学方程式表示为4C2H5OH+9O2 ![]() 2CO2+12H2O+6CO,生成的CO和CO2分子个数比=2:6=1:3,B不符合题意;
2CO2+12H2O+6CO,生成的CO和CO2分子个数比=2:6=1:3,B不符合题意;
C、参加反应的乙醇和氧气的质量比=4.6g:8.8g=23:44,C符合题意;
D、根据质量守恒定律化学反应前后元素的种类和质量不变可知,在化学反应前后碳元素质量一定相等,D不符合题意。
所以答案是:C。
【考点精析】利用质量守恒定律及其应用对题目进行判断即可得到答案,需要熟知①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.

【题目】在实验课上,同学们将CO2通入到Ca(OH)2溶液中观察到有白色沉淀生成,而将CO2通入到NaOH溶液中无明显现象。
【提出问题】CO2与NaOH溶液是否发生了化学反应?
【提出猜想】CO2与NaOH溶液发生了化学反应
【实验探究】小明设计出了下列4种实验装置,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低。
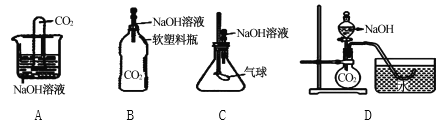
⑴实验现象为:A中试管内液面上升,B中___________________,C中__________________,D中水槽中的水部分进入烧瓶。
⑵小宁对小明的方案提出了质疑,他认为小明的实验不严谨,其理由是__________________要得到科学严谨的结论,利用方案A,补做的对比实验是_______________________。
⑶小丽的改进方案是利用反应后的溶液来验证猜想,请完成实验报告。
实验操作 | 实验现象 | 实验结论 |
向实验后的溶液中加入稀盐酸 | _______________ | 猜想正确 |
【得出结论】CO2与NaOH溶液发生了化学反应,请写出CO2与NaOH反应的化学方程式:___________________。