题目内容
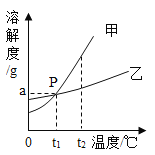
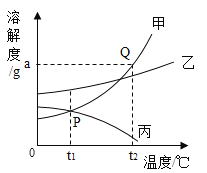
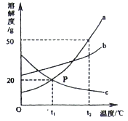
【题目】钙元素是人必需的常量元素,正常人每升血液含钙88~108 mg。现按下列步骤测定某血样的含钙量:①取血样10 mL,将血样中的钙元素全部转化到CaC2O4中;②用稀硫酸处理CaC2O4,反应的化学方程式为CaC2O4+H2SO4=CaSO4+H2C2O4;③测得上述反应中所得H2C2O4的质量为2.25 mg。计算并判断(要求写出计算过程):
(1)每10 mL该血样可转化生成的CaC2O4质量。
(2)每升该血样中钙元素的质量,并判断该血样含钙量是否正常。
【答案】(1)3.2mg
(2)100mg,正常
【解析】
(1)解:设可生成CaC2O4质量为x。
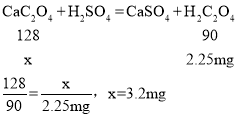
故每10 mL该血样可转化生成的CaC2O4质量3.2mg。
(2)10ml血样中钙元素质量:3.2mg×![]() =1mg,故每升血样中钙元素质量1mg×100=100mg,符合正常人血液含钙88~108 mg,正常。
=1mg,故每升血样中钙元素质量1mg×100=100mg,符合正常人血液含钙88~108 mg,正常。
答:每升该血样中钙元素的质量100mg,该血样含钙量正常。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
【题目】生产、生活和科技发展离不开化学。请回答下列问题:
(1)端午节是中国传统节日,吃粽子已成传统风俗。在制作粽子的原料中,糯米所富含的营养素是_____________。
(2)在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),可在燃气泄漏时及时发现,其燃烧的化学方程式为2C2H5SH+9O2![]() 4CO2+2X+6H2O,则X的化学式为_______。
4CO2+2X+6H2O,则X的化学式为_______。
(3)下表列出了家庭中一些常用物品的pH:
物品 | 食醋 | 牙膏 | 食盐溶液 | 肥皂水 |
pH | 3 | 9 | 7 | 10 |
黄蜂的刺是碱性的,若你被黄蜂刺了,应用上述物质中的_________ 涂在皮肤上。