题目内容
【题目】下面是甲、乙两同学在学完酸的化学性质后所做的实验:
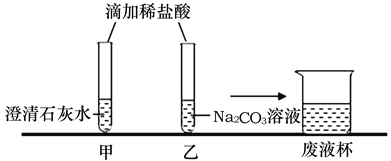
(实验探究一)
甲同学在两物质充分反应后,再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性)。
(实验探究二)
乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑。他通过查阅资料得知:
在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HC1=NaC1+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl=NaC1+H2O+CO2↑。所以他认为,实验时还应_________,才能观察到有气泡产生。
(实验探究三)
甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象。经过讨论确定,甲同学的试管废液中含有的溶质一定有____(填化学式,下同),乙同学的试管废液中含有的溶质一定有____。
为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液的成分进行探究。
(提出问题)最终废液中含有什么溶质?
(猜想与假设)
猜想1:废液中含有______________两种溶质。
猜想2:废液中含有____________________________三种溶质。
猜想3:废液中含有NaHCO3、CaC12、NaCl三种溶质。
(活动与探究)
甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加盐酸,无气泡产生。
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变红色。
(结论与反思)
(1)猜想_________ (填“1”或“2”或“3”)正确。
(2)要得到相同的结论,还可采用很多种方法。如加入氧化铁粉末,可观察到溶液呈___色,该反应的化学方程式为_______________
【答案】 继续加入稀盐酸 CaCl2 NaCl CaCl2、NaCl CaCl2、NaCl、HCl 2 黄; Fe2O3+6HCl=2FeCl3+3H2O
【解析】根据所学知识和题中信息知,【实验探究一】甲同学在两物质充分反应后,再滴加无色酚酞溶液,无明显现象,酚酞溶液遇碱变红,说明石灰水已完全反应。【实验探究二】乙做实验时开始没有观察到气泡产生,对碳酸钠能否与盐酸反应进行分析,在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HC1=NaC1+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl=NaC1+H2O+CO2↑。实验时还应继续加入稀盐酸,才能观察到有气泡产生。【实验探究三】甲先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象。甲试管废液中含有的溶质一定有CaCl2,石灰水和稀盐酸反应生成了氯化钙;乙试管废液中含有的溶质一定有NaCl,稀盐酸与碳酸钠反应生成了氯化钠。为了处理实验后产生的废液,甲、乙决定对废液杯中最终废液的成分进行探究。猜想1:废液中含有CaCl2、NaCl,甲、乙实验均全部恰好完全反应。猜想2:废液中含有CaCl2、NaCl、HCl,甲或乙实验中出现盐酸过量。猜想3:废液中含有NaHCO3、CaC12、NaCl三种溶质。【活动与探究】甲实验:取少量废液于试管中,向其中滴加盐酸,无气泡产生。乙实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变红色。【结论与反思】(1)猜想2正确,滴加紫色石蕊试液,溶液变红色,酸可以使紫色石蕊试液变红。(2)要得到相同的结论,还可采用很多种方法。如加入氧化铁粉末,与稀盐酸反应生成氯化铁,氯化铁溶液呈黄色,可观察到溶液呈黄色,该反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O。
点睛∶这是一道实验探究题,在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HC1=NaC1+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl=NaC1+H2O+CO2↑。在化学反应中要成分考虑到反应物是否过量的问题。

【题目】下表是几种家用清洁剂的功能和有效成分。
清洁剂 |
洁厕灵 |
彩漂液 |
漂白水 |
功 能 | 清除污垢,除异味 | 漂洗衣物,使色彩鲜艳 | 漂除衣物污渍 |
有效成分 | 盐酸(HCl) | 过氧化氢 | 次氯酸钠(NaClO) |
根据表中信息,回答下列问题。
(1)HCl中氯元素的化合价为___________。
(2)若大理石的污垢用洁厕灵清洗,主要现象是______________。
(3)在盛有少量“彩漂液”的试管中,加少量二氧化锰,发生反应的化学方程式为____,其基本反应类型是_________。
(4)“洁厕灵”与“漂白水”不能混用。二者若混合,其有效成分之间能发生化学反应,产生氯化钠、水和有毒的氯气(Cl2),化学方程式为______________。