题目内容
【题目】碳家族是是化学世界里最大的家族,一直受到人们关注。
(1)甲烷(CH4)— 最简单的含碳化合物。
①化学家在较低的温度和压力下,用甲烷等为原料制成了金刚石薄膜,该变化属于_____(填“物理变化”或‘化学变化”)。
②已知在相同条件下,相同体积的气体所含的分子数目相同,CO、CH4燃烧的化学方程式分别为:2CO+O2![]() 2CO2;CH4+2O2
2CO2;CH4+2O2![]() CO2+2H2O。据此分析,在相同条件下,分别燃烧1米3的CO和1米3的CH4,消耗氧气的质量比是________________。
CO2+2H2O。据此分析,在相同条件下,分别燃烧1米3的CO和1米3的CH4,消耗氧气的质量比是________________。
③常温常压时,由甲烷和另两种气体组成的混合物中,碳元素的质量分数为80%,则另两种气体可能是__________(填字母序号)。
A.H2和C2H6 B.H2和C2H2 C.CO和C2H6 D.C2H2和C2H4
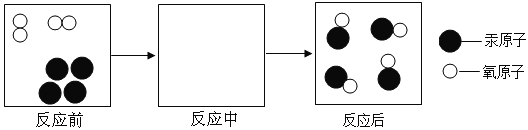
④甲烷和水反应后可以制成水煤气,其反应的微观示意图如下所示,根据微观示意图得出的结论中,正确的是_________(填字母序号)。
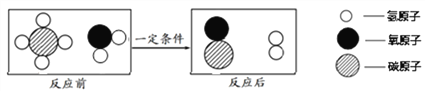
A.反应前后各元素的化合价均不变 B.反应后所得的水煤气是混合物
C.该反应中含氢元素的化合物有2种 D.该反应中分子的种类不变
(2)CO2 — 常见的含碳化合物
①造成大气中CO2含量增加的主要原因是________(填字母序号)。
A.动植物的呼吸作用 B.实验室逸出CO2 C.化石燃料的大量燃烧
②汽车尾气中的CO和NO,在催化剂作用下能转化为CO2和N2,该反应中CO和NO的分子个数比为________________。
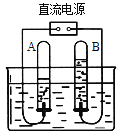
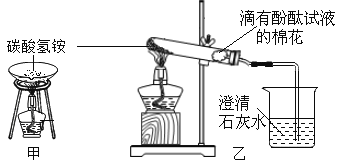
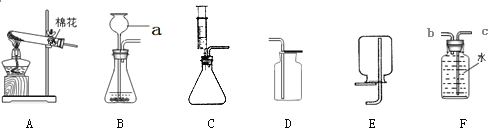
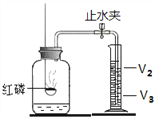
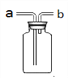
③实验室常用石灰石和稀盐酸制取二氧化碳,用下图装置检验气体是否是CO2,瓶内装入的物质是____________,若用右图装置收集CO2,CO2应从______通入。
④学校化学兴趣小组同学为测定本次实验中所用石灰石中碳酸钙的质量分数。称取一定质量的石灰石样品,把50g稀盐酸分5次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 4.0g |
第二次加入10g | 3.0g |
第三次加入10g | 2.0g |
第四次加入10g | Xg |
第四次加入10g | 0.5g |
请计算:
Ⅰ.表中X的数值是______
Ⅱ.这种石灰石样品中碳酸钙的质量分数是______ 。
Ⅲ.这些样品完全反应共产生CO2的质量是______?(写出计算过程,结果精确到0.01g)
【答案】 化学变化 1:4 B D B C A C 1:1 澄清石灰水 a 1.0 90% 1.98g
【解析】(1)①用甲烷等为原料制成了金刚石薄膜,该过程生成了新物质,属于化学变化;②由CO、CH4燃烧的化学方程式分别为2CO+O2![]() 2CO2;CH4+2O2
2CO2;CH4+2O2![]() CO2+2H2O;可知:2CO~O2、2CH4~4O2;已知在相同条件下,1米3CO和1米3CH4所含的分子数目相同,则在相同条件下,分别燃烧1米3的CO与CH4,消耗氧气的质量比是:1:4;③甲烷中,碳元素的质量百分比=
CO2+2H2O;可知:2CO~O2、2CH4~4O2;已知在相同条件下,1米3CO和1米3CH4所含的分子数目相同,则在相同条件下,分别燃烧1米3的CO与CH4,消耗氧气的质量比是:1:4;③甲烷中,碳元素的质量百分比=![]() ×100%=75%,CO中碳元素的质量百分比=
×100%=75%,CO中碳元素的质量百分比=![]() ×100%=42.9%;C2H2中碳元素的质量百分比=
×100%=42.9%;C2H2中碳元素的质量百分比=![]() ×100%=92.3%;C2H4中碳元素的质量百分比=
×100%=92.3%;C2H4中碳元素的质量百分比=![]() ×100%=85.7%;C2H6中碳元素的质量百分比=
×100%=85.7%;C2H6中碳元素的质量百分比=![]() ×100%=80%;因为混合气体的碳元素质量分数为80%,而甲烷<80%,所以,另两种气体的含碳量一定要>80% 才能使混合气体中碳元素质量分数达到80%,A中H2和C2H6 小于 80%,B中H2和C2H2大于80%, C中CO和C2H6中小于80%, D中C2H2和C2H4 大于80%;④由图示可知,该反应的反应物是甲烷和水,生成物是一氧化碳和氢气,反应的化学方程式为:CH4+H2O
×100%=80%;因为混合气体的碳元素质量分数为80%,而甲烷<80%,所以,另两种气体的含碳量一定要>80% 才能使混合气体中碳元素质量分数达到80%,A中H2和C2H6 小于 80%,B中H2和C2H2大于80%, C中CO和C2H6中小于80%, D中C2H2和C2H4 大于80%;④由图示可知,该反应的反应物是甲烷和水,生成物是一氧化碳和氢气,反应的化学方程式为:CH4+H2O![]() CO+3H2,A、该反应的生成物中有单质生成,一定有化合价发生改变,故错;B、生成物是一氧化碳和氢气,水煤气的成分是一氧化碳和氢气,故对;C、由上述方程式可知,该反应中含氢元素的化合物有2种,故对;D、化学反应前后分子的种类一定变,故错;故选D;(2)①大量燃烧化石燃料,可产生大量的二氧化碳,是大气中二氧化碳含量增加的主要原因;②在催化剂的作用下能使尾气中的CO和NO转化为N2和CO2,反应的化学方程式为:2CO+2NO
CO+3H2,A、该反应的生成物中有单质生成,一定有化合价发生改变,故错;B、生成物是一氧化碳和氢气,水煤气的成分是一氧化碳和氢气,故对;C、由上述方程式可知,该反应中含氢元素的化合物有2种,故对;D、化学反应前后分子的种类一定变,故错;故选D;(2)①大量燃烧化石燃料,可产生大量的二氧化碳,是大气中二氧化碳含量增加的主要原因;②在催化剂的作用下能使尾气中的CO和NO转化为N2和CO2,反应的化学方程式为:2CO+2NO![]() N2+2CO2,该反应中CO和NO的分子个数比为1:1;③实验室常用石灰石和稀盐酸制取二氧化碳,常用澄清石灰水检验是否是二氧化碳,应为二氧化碳的密度比空气大且能溶于水,只能用向上排空汽法收集,所以应从a端进入;④Ⅰ.由第一次和第二次的反应可以发现10g盐酸能够消耗1g碳酸钙,而最后剩余的0.5g即是碳酸钙中的杂质,而第三次的固体是2g,所以X的值应该是1g;Ⅱ.最后剩余的0.5克为杂质质量,所以石灰石中碳酸钙的质量为5g-0.5g=4.5g;石灰石中碳酸钙的质量分数为
N2+2CO2,该反应中CO和NO的分子个数比为1:1;③实验室常用石灰石和稀盐酸制取二氧化碳,常用澄清石灰水检验是否是二氧化碳,应为二氧化碳的密度比空气大且能溶于水,只能用向上排空汽法收集,所以应从a端进入;④Ⅰ.由第一次和第二次的反应可以发现10g盐酸能够消耗1g碳酸钙,而最后剩余的0.5g即是碳酸钙中的杂质,而第三次的固体是2g,所以X的值应该是1g;Ⅱ.最后剩余的0.5克为杂质质量,所以石灰石中碳酸钙的质量为5g-0.5g=4.5g;石灰石中碳酸钙的质量分数为![]() ×100%=90%;Ⅲ.一次性加入50g盐酸充分反应后并过滤,会的到固体的质量是0.5g,故反应的碳酸钙的质量是4.5g;设生成CO2的质量为x,CaCO3+2HCl=CaCl2+H2O+CO2↑
×100%=90%;Ⅲ.一次性加入50g盐酸充分反应后并过滤,会的到固体的质量是0.5g,故反应的碳酸钙的质量是4.5g;设生成CO2的质量为x,CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
4.5g x
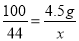
x=1.98g。