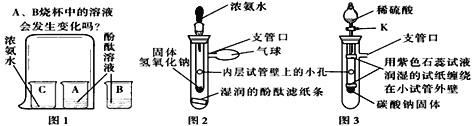
题目内容
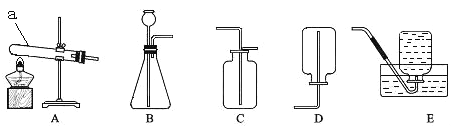
【题目】请根据下列装置图,回答有关问题:
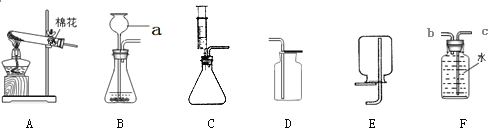
(1)写出装置图中标号仪器的名称:a___________。
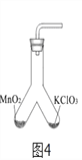
(2)若实验室用高锰酸钾制取氧气,反应的符号表达式是______________________,若要制取并收集一瓶比较干燥的氧气,应选用的装置组合是_________(填字母),检验该气体已收集满的方法是________________________________________。
(3)若实验室用过氧化氢制取氧气,反应的符号表达式是________________,若要用F装置收集氧气,则氧气从_______端(填“b”或“c”)进入,选用该装置收集氧气的依据是________,
若将B装置换成C装置,则优点是______________________________。
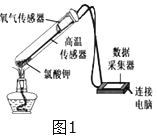
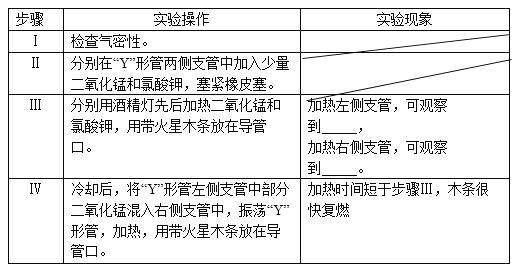
(4)利用下图的装置,可以粗略测定出空气中氧气的体积分数。实验过程如下:
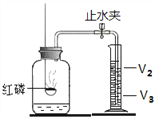
第1步:在一个容积为V毫升的集气瓶中加入V1毫升(少量)的水,量筒中预先装入V2毫升的水。
第2步:点燃燃烧匙内的红磷,并迅速伸入集气瓶中再塞紧塞子。
第3步:待反应结束并冷却后,松开止水夹。此时水进入集气瓶,最终量筒中的水面停止在刻度V3毫升处。
请回答下列问题:
①在此设计方案中,红磷燃烧的符号表达式是_______________________。
②实验中红磷必须要过量,目的是:_______________________________。
③该方案中计算空气中氧气的体积分数的数学表达式为:______________。
【答案】 长颈漏斗 略 AD 将带火星的小木条放在瓶口,木条复燃说明氧气已满 略 b 氧气不易溶于水 控制反应速率 略 将集气瓶中的氧气全部耗尽 ,使实验结果更准确 略
【解析】(1) 通过分析题中所指仪器的作用可知,a是长颈漏斗;(2) 实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,反应的符号表达式是:2KMnO4![]() K2MnO4+MnO2+O2↑;所以应选用的发生装置是A,向上排空气法收集的氧气纯净,排水法收集的氧气干燥,所以要制取并收集一瓶较干燥的氧气,应选用的装置组合为AD,氧气有助燃性,所以检验氧气是否收集满的方法为:将带火星的小木条放在集气瓶口,看是否复燃;(3) 实验室用过氧化氢制取氧气,反应的符号表达式是:2H2O2
K2MnO4+MnO2+O2↑;所以应选用的发生装置是A,向上排空气法收集的氧气纯净,排水法收集的氧气干燥,所以要制取并收集一瓶较干燥的氧气,应选用的装置组合为AD,氧气有助燃性,所以检验氧气是否收集满的方法为:将带火星的小木条放在集气瓶口,看是否复燃;(3) 实验室用过氧化氢制取氧气,反应的符号表达式是:2H2O2![]() 2H2O+O2↑ ;若用F装置收集该气体,瓶内装满的是水,则气体从b端进入,是因为氧气不易溶于水;若将B装置换成C装置,则优点是可以得到比较平稳的气流、便于控制反应的剧烈程度等;(4) :①在此设计方案中,不能用木炭代替红磷,因为木炭燃烧生成物为气体,不能测定消耗的氧气量;②实验中红磷必须要过量,目的是耗尽集气瓶中的氧气;③该方案中计算空气中氧气的体积分数的数学表达式为(V2-V3)÷(V-V1)×100%。
2H2O+O2↑ ;若用F装置收集该气体,瓶内装满的是水,则气体从b端进入,是因为氧气不易溶于水;若将B装置换成C装置,则优点是可以得到比较平稳的气流、便于控制反应的剧烈程度等;(4) :①在此设计方案中,不能用木炭代替红磷,因为木炭燃烧生成物为气体,不能测定消耗的氧气量;②实验中红磷必须要过量,目的是耗尽集气瓶中的氧气;③该方案中计算空气中氧气的体积分数的数学表达式为(V2-V3)÷(V-V1)×100%。

 阅读快车系列答案
阅读快车系列答案【题目】碳家族是是化学世界里最大的家族,一直受到人们关注。
(1)甲烷(CH4)— 最简单的含碳化合物。
①化学家在较低的温度和压力下,用甲烷等为原料制成了金刚石薄膜,该变化属于_____(填“物理变化”或‘化学变化”)。
②已知在相同条件下,相同体积的气体所含的分子数目相同,CO、CH4燃烧的化学方程式分别为:2CO+O2![]() 2CO2;CH4+2O2
2CO2;CH4+2O2![]() CO2+2H2O。据此分析,在相同条件下,分别燃烧1米3的CO和1米3的CH4,消耗氧气的质量比是________________。
CO2+2H2O。据此分析,在相同条件下,分别燃烧1米3的CO和1米3的CH4,消耗氧气的质量比是________________。
③常温常压时,由甲烷和另两种气体组成的混合物中,碳元素的质量分数为80%,则另两种气体可能是__________(填字母序号)。
A.H2和C2H6 B.H2和C2H2 C.CO和C2H6 D.C2H2和C2H4
④甲烷和水反应后可以制成水煤气,其反应的微观示意图如下所示,根据微观示意图得出的结论中,正确的是_________(填字母序号)。
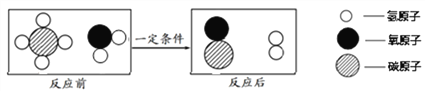
A.反应前后各元素的化合价均不变 B.反应后所得的水煤气是混合物
C.该反应中含氢元素的化合物有2种 D.该反应中分子的种类不变
(2)CO2 — 常见的含碳化合物
①造成大气中CO2含量增加的主要原因是________(填字母序号)。
A.动植物的呼吸作用 B.实验室逸出CO2 C.化石燃料的大量燃烧
②汽车尾气中的CO和NO,在催化剂作用下能转化为CO2和N2,该反应中CO和NO的分子个数比为________________。
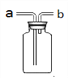
③实验室常用石灰石和稀盐酸制取二氧化碳,用下图装置检验气体是否是CO2,瓶内装入的物质是____________,若用右图装置收集CO2,CO2应从______通入。
④学校化学兴趣小组同学为测定本次实验中所用石灰石中碳酸钙的质量分数。称取一定质量的石灰石样品,把50g稀盐酸分5次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 4.0g |
第二次加入10g | 3.0g |
第三次加入10g | 2.0g |
第四次加入10g | Xg |
第四次加入10g | 0.5g |
请计算:
Ⅰ.表中X的数值是______
Ⅱ.这种石灰石样品中碳酸钙的质量分数是______ 。
Ⅲ.这些样品完全反应共产生CO2的质量是______?(写出计算过程,结果精确到0.01g)