题目内容
【题目】根据下列要求写出有关反应的化学方程式
(1)红磷在空气中燃烧:_______________________________________________。
(2)细铁丝在氧气中燃烧:____________________________________________。
(3)实验室用加热高锰酸钾的方法制取氧气:____________________________。
【答案】 4P+5O2![]() 2P2O5 3Fe+ 2O2
2P2O5 3Fe+ 2O2![]() Fe3O4 2KMnO4
Fe3O4 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
【解析】书写化学方程式的步骤一般有四步:1.根据实验事实,在式子的左、右两边分别写出反应物和生成物的化学式,并在式子的左、右两边之间画一条短线;当反应物或生成物有多种时,中间用加号(即“+”)连接起来.2.配平化学方程式,并检查后,将刚才画的短线改写成等号(表示式子左、右两边每一种元素原子的总数相等).3.标明化学反应发生的条件(因为化学反应只有在一定的条件下才能发生);如点燃、加热(常用“△”号表示)、催化剂、通电等.并且,一般都写在等号的上面,若有两个条件,等号上面写一个下面写一个.4.注明生成物中气体或固体的状态符号(即“↑”、“↓”);一般标注在气体或固体生成物的化学式的右边.但是,如果反应物和生成物中都有气体或固体时,其状态符号就不用标注了。
(1)红磷在空气中燃烧:4P+5O2 ![]() 2P2O5;(2)细铁丝在氧气中燃烧:3Fe+ 2O2
2P2O5;(2)细铁丝在氧气中燃烧:3Fe+ 2O2 ![]() Fe3O4;(3)实验室用加热高锰酸钾的方法制取氧气:2KMnO4
Fe3O4;(3)实验室用加热高锰酸钾的方法制取氧气:2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑

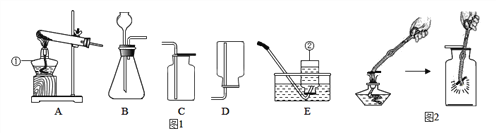
【题目】下列实验方案与实验结论相对应的是
选项 | ① | ② | ③ | ④ |
方案 |
|
|
|
|
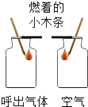
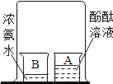
结论 | 比较呼出气体中CO2含量较空气中的多 | 说明白烟的成分不是二氧化碳 | 说明氨分子在不断地运动,而酚酞分子不运动 | 说明液态水与气态水可以相互转化 |
A. ①②④ B. ①④ C. ①②③④ D. ②④
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后。某同学想:Fe2O3能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
【猜想】Ⅰ、Fe2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、Fe2O3参与反应产生O2,反应前后质量和化学性质发生了变化;
Ⅲ、Fe2O3是反应的催化剂,反应前后_________________ 。
【查阅资料】Fe2O3属于碱性氧化物,能够与稀盐酸反应生成氯化铁;氯化铁溶液显棕黄色。
【实验】用天平称量0.3gFe2O3,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
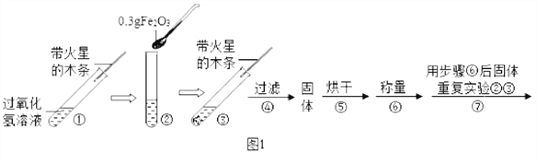
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
________________; 带火星的木条复燃。 | _________________ | 溶液中有气泡冒出, _______________。 | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |
(2)步骤①的目的是_____________________;
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、_______ 。
(4)过氧化氢能被Fe2O3催化分解放出氧气的化学方程式为____________________。
【拓展】 (1)要探究步骤⑤做过催化剂的Fe2O3其他化学性质,还应补做的实验是________。
(2)该学生为了继续探究Fe2O3 的用量对H2O2分解速率的影响,每次均用30mL10%的H2O2溶液,使用不同质量的Fe2O3作催化剂,测定每次收集到500mLO2所用的时间。结果图上图(其他实验条件相同):
由图可知,Fe2O3 的用量对H2O2分解速率影响的规律是:①___________________________ ;
②Fe2O3 的用量超过 一定范围后,其用量再增大,反应速率不再继续加快。