题目内容
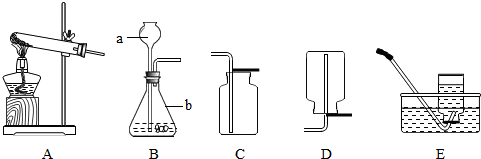
(2012?闵行区一模)下图是配制100g溶质质量分数为10%的NaCl溶液实验操作示意图.
(1)用上图的序号表示配制溶液的正确操作顺序
(2)图④中,有一种塑料仪器,其名称是
(3)根据计算需要量取水的体积是

(4)在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是
①用量筒量取水时俯视读数 ②配制溶液的烧杯用少量蒸馏水润洗
③氯化钠晶体不纯 ④将配好的氯化钠溶液转移到细口瓶时,不慎洒出部分溶液.

(1)用上图的序号表示配制溶液的正确操作顺序
④⑤③②①
④⑤③②①
.(2)图④中,有一种塑料仪器,其名称是
药匙
药匙
.(3)根据计算需要量取水的体积是
90mL
90mL
(水的密度为1g/mL).量取读数时,下图视线角度正确的是D
D
.(选填字母标号)
(4)在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是
②③
②③
(填序号).①用量筒量取水时俯视读数 ②配制溶液的烧杯用少量蒸馏水润洗
③氯化钠晶体不纯 ④将配好的氯化钠溶液转移到细口瓶时,不慎洒出部分溶液.
分析:(1)根据利用固体溶质氯化钠配制溶液的步骤,对操作进行排序;
(2)图④的操作为用药匙取用固体粉末状氯化钠,需要使用的仪器为药匙;
(3)利用所称取溶质氯化钠的质量和抽要配制溶液的溶洞质质量分数,根据溶质质量分数计算公式,求出所要配制溶液的质量,溶液质量与溶质质量差即为溶剂水的质量,水的质量g即为水的体积mL;使用量筒量取液体时,视线应与凹液面最低处保持在同一水平线上;
(4)由公式:溶质质量分数=
×100%可以看出,若溶质质量偏小,将导致溶质质量分数偏小;若溶剂质量偏大也会导致溶质质量分数偏小.针对每项操作分析,将导致溶质或溶剂的质量如何改变,最后作出正确判断.
(2)图④的操作为用药匙取用固体粉末状氯化钠,需要使用的仪器为药匙;
(3)利用所称取溶质氯化钠的质量和抽要配制溶液的溶洞质质量分数,根据溶质质量分数计算公式,求出所要配制溶液的质量,溶液质量与溶质质量差即为溶剂水的质量,水的质量g即为水的体积mL;使用量筒量取液体时,视线应与凹液面最低处保持在同一水平线上;
(4)由公式:溶质质量分数=
| 溶质质量 |
| 溶质质量+溶剂质量 |
解答:解:(1)根据用固体溶质氯化钠配制溶液的步骤:计算-称量-溶解,先取氯化钠进行称取,倒入烧杯;然后量取水,倒入盛氯化钠的烧杯中;最后进行溶解;
(2)其中塑料仪器为取用粉末状药品的药匙;
(3)所配制溶液中溶质的质量=100g×10%=10g,则需要水的质量=100g-10g=90g合90ml(水的密度为1g/mL);使用量筒量取液体时,平视,视线与凹液面最低点保持在同一水平面上;
(4)①用量筒量取水时俯视读数,将导致所取水体积偏小,导致溶质质量分数偏大;
②配制溶液的烧杯用少量蒸馏水润洗会使所取水质量增加,导致溶质质量分数偏小;
③氯化钠晶体不纯,会使所得溶质质量中一部分为杂质质量,所得氯化钠质量偏小,导致溶质质量分数偏小.
④溶液在烧杯配好后转移到试剂瓶中时不慎洒落几滴,溶液具有均一性,洒落的溶液不会影响溶液的质量分数;
所以②③正确;
故答案为:(1)④⑤③②①(2)药匙(3)90;D(4)②③
(2)其中塑料仪器为取用粉末状药品的药匙;
(3)所配制溶液中溶质的质量=100g×10%=10g,则需要水的质量=100g-10g=90g合90ml(水的密度为1g/mL);使用量筒量取液体时,平视,视线与凹液面最低点保持在同一水平面上;
(4)①用量筒量取水时俯视读数,将导致所取水体积偏小,导致溶质质量分数偏大;
②配制溶液的烧杯用少量蒸馏水润洗会使所取水质量增加,导致溶质质量分数偏小;
③氯化钠晶体不纯,会使所得溶质质量中一部分为杂质质量,所得氯化钠质量偏小,导致溶质质量分数偏小.
④溶液在烧杯配好后转移到试剂瓶中时不慎洒落几滴,溶液具有均一性,洒落的溶液不会影响溶液的质量分数;
所以②③正确;
故答案为:(1)④⑤③②①(2)药匙(3)90;D(4)②③
点评:本题对使用氯化钠配制溶液的基本过程进行考查,其中涉及溶液组成的计算、实验误差的分析等,属基础性知识考查题.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目