题目内容
【题目】结合下列实验装置图,回答有关问题:
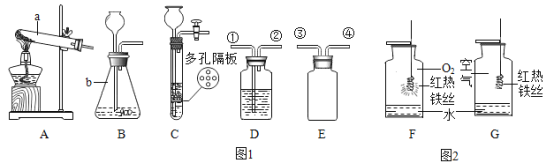
(1)仪器 b 的名称为_____。
(2)实验室用氯酸钾制取氧气应选择的发生装置是_____(填字母),该反应的化学方程式为_____。
(3)对于实验室制取气体,小虹总结了如下规律,你认为正确的是_____。
a.反应必须加热 b.反应物必须是纯净物 c.生成物中只有一种气体
(4)实验室常用装置 C 代替 B 制取气体,装置 C 的优点是_____。
(5)实验室用 B 制取气体,欲验证制得的气体为二氧化碳,应在装置 D 中盛放_____试剂(填试剂名称),并把气体从_____端通入。
(6)用 E 收集二氧化碳,从③端通入,请把右边E装置图补画齐全_____。
(7)制得的氧气用于图 2 所示的实验,发现 G 中铁丝不燃烧,原因是_____。
【答案】锥形瓶 A 2KClO3![]() 2KCl+3O2↑ c 可以控制反应的发生和停止 澄清石灰水 ①
2KCl+3O2↑ c 可以控制反应的发生和停止 澄清石灰水 ① 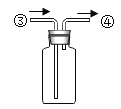 空气中氧气体积分数低或含氧量低
空气中氧气体积分数低或含氧量低
【解析】
(1)锥形瓶是常用的反应容器,故答案为:锥形瓶;
(2)如果用氯酸钾制取氧气就需要加热,氯酸钾在加热和二氧化锰催化作用下生成氯化钾和氧气,要注意配平;故答案为:A;2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)a.反应不一定需要加热,如实验室制取二氧化碳是在常温下进行的,故错误;
b.过氧化氢溶液在二氧化锰催化作用下制取氧气,反应物不是纯净物,故错误;
c. 只生成一种气体,这样制得的气体才纯净,故正确;
故答案为:c;
(4)装置C的优点是:可以控制反应的发生和停止;故答案为:可以控制反应的发生和停止;
(5)二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;检验气体时,要长进短出;故答案为:澄清的石灰水;①;
(6)用E收集二氧化碳,要长进短出,因为二氧化碳的密度比空气大;故答案为: ;
;
(7)制得的氧气用于图2所示的实验,发现G中铁丝不燃烧,原因是:空气中氧气体积分数低或含氧量低;故答案为:空气中氧气体积分数低或含氧量低。

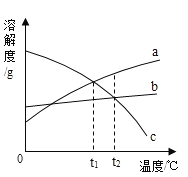
【题目】根据下列溶解度曲线和A物质的部分温度是的溶解度判断下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | A物质 | 20 | 28 | 45 | 60 |
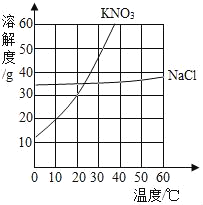
A. 由上图可知,KNO3和NaCl的溶解度均大于A 物质的溶解度
B. 10℃时,将40gNaCl放入50g水中,充分溶解,所得溶液是NaCl的不饱和溶液
C. 将30℃时NaCl、KNO3、和A物质的饱和溶液各降温至10℃,所得溶液的溶质质量分数大小为:KNO3>NaCl>A
D. 20℃时,将KNO3、NaCl和A物质各30g分别配制成恰好饱和溶液,所得溶液的质量大小为A>KNO3=NaCl
【题目】某学校化学活动小组的同学对碳酸钠与稀盐酸的反应进行了下列探究:
[探究一]向放有一支燃着的蜡烛的烧杯中加适量碳酸钠和稀盐酸(如图1所示):
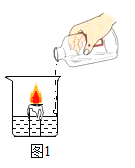
(1)烧杯中看到的现象是:______________,说明二氧化碳具有的化学性质是:___________ 。
(2)碳酸钠与稀盐酸反应产生的气体具有的另一个用途是____________ 。
[探究二]碳酸钠与稀盐酸反应后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质溶于水,不参加反应且呈中性)。甲、乙两同学分析认为剩余溶液中一定含有氯化钠,可能有盐酸或碳酸钠。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钠溶液呈中性
实验操作 | 实验现象 | 结论 | |
甲 | 取样于试管中,滴加__________试液 | 试液变红 | 有盐酸 |
乙 | 取样于试管中,逐滴滴加碳酸钠溶液 | ______________ |
[探究三]测定所用稀盐酸的溶质质量分数?[实验原理]通过测定足量碳酸钠样品与一定质量的稀盐酸反应生成二氧化碳的体积来计算稀盐酸的溶质质量分数。
[实验设计]小伍称取一定质量的样品,按如图2装置进行实验(已知该装置气密性良好,水准管高度可以上下调节,量气管是带有刻度的仪器)。
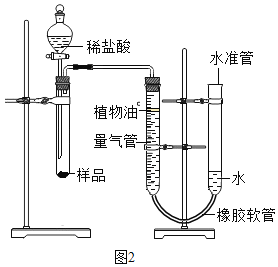
[反思与评价](1)在实验中,若没有植物油,测定结果会________(填“偏大”、“偏小”或“不变”)。
(2)操作中,下列情况不影响测定结果的是___________(填字母).
A实验前试管中有空气 B实验中水准管口有水溢出
C读数时量气管和水准管液面不相平 D实验后生成的气体在试管中仍有滞留