题目内容
【题目】下图是我们学过的几个重要实验,分析四个实验,回答问题
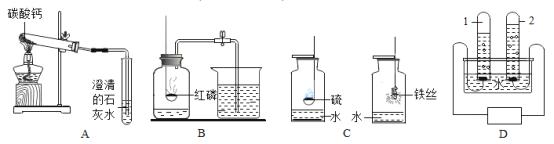
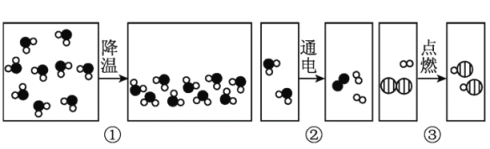
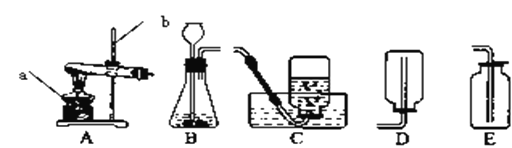
(1)A实验中铁架合夹持的试管中发生反应的化学方程式为______________;
(2)B实验有时测得空气中氧气体积分数小于五分之一,其原因可能是(只答一条)______;
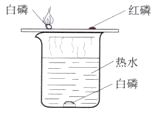
(3)C实验的①②两个集气瓶中都存有少量水,任选一个写出水所起的作用________;铁丝燃烧的实验现象是:剧烈燃烧,__________________。
(4)D实验中试管“1连接的是电源的_____(填“正”负")极,电解水的反应方程式为_____。
【答案】CaCO3![]() CaO+CO2↑ 红磷的量不足等 硫燃烧实验中水能起到吸收生成的二氧化硫的作用或铁丝燃烧实验中是防止铁燃烧的高温熔化物溅落炸裂瓶底的作用 火星四射,放出大量的热,生成黑色固体 负 2H2O
CaO+CO2↑ 红磷的量不足等 硫燃烧实验中水能起到吸收生成的二氧化硫的作用或铁丝燃烧实验中是防止铁燃烧的高温熔化物溅落炸裂瓶底的作用 火星四射,放出大量的热,生成黑色固体 负 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】
(1)A实验中铁架台夹持的试管中,碳酸钙能高温反应生成氧化钙和二氧化碳,发生反应的化学方程式为CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(2)B实验有时测得空气中氧气体积分数小于五分之一,可能是因为红磷的量不足;
(3)C实验中,硫燃烧实验中水能起到吸收生成的二氧化硫的作用,铁丝燃烧实验中是防止铁燃烧的高温熔化物溅落炸裂瓶底的作用;铁丝燃烧的实验现象是:剧烈燃烧,火星四射,放出大量的热,生成黑色固体;
(4)D实验中试管“1”产生的气体体积大,故连接的是电源的负极,电解水的反应方程式为2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。

【题目】实验室有一瓶配制数天的Na2SO3溶液,现在对其成分进行检测:
(成分猜想)猜想一:只有Na2SO3;
猜想二:_____;
猜想三:既有Na2SO3,也有Na2SO4。
(查阅资料)①Na2SO3易被空气中的氧气氧化生成Na2SO4.②BaSO4不溶于稀盐酸和稀硫酸。③Na2SO3和盐酸、硫酸反应均生成SO2。
(方案设计)
方案 | 实验操作 | 实验现象 | 结论 |
一 |
①加入足量的稀盐酸 ②再加入足量的BaCl2溶液 | _____ | 猜想三正确 |
二 | ①加入足 ②再加入足量的BaCl2溶液 | 有气体和白色沉淀生成 | 猜想一或猜想三正确 |
(方案分析)
(1)方案一中的实验现象为_____;方案一中加入BaCl2溶液后发生反应的化学方程式为_____。
(2)方案二的设计是否合理:_____(填“合理”或“不合理”);若不合理。理由是_____。
(实验结论)通过分析比较,方案设计_____(填“一”或“二”)合理。