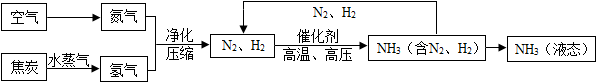
题目内容
某学校课外活动小组的同学为了测定一钢铁厂生产的铁合金中铁的质量分数,在实验室称取铁合金样品5.8g放入烧杯中(烧杯的质量为30g).然后再加入50g稀硫酸,使之充分反应后,称量,烧杯及烧杯中物质的总质量为85.6g(已知该反应中稀硫酸恰好完全反应完,杂质不参与反应,不溶于水).请计算并回答:
(1)该铁合金属于生铁还是钢?
(2)反应后所得溶液中溶质的质量分数是多少?(精确到0.1%)
(1)该铁合金属于生铁还是钢?
(2)反应后所得溶液中溶质的质量分数是多少?(精确到0.1%)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)生铁为铁与碳所形成的合金,其中铁能与稀硫酸发生反应放出氢气而碳不能与稀硫酸反应;根据质量守恒定律,利用反应前后烧杯内物质质量差,可计算反应放出氢气质量;根据铁与硫酸反应的化学方程式,由放出氢气质量计算出反应中消耗铁的质量,该质量即生铁样品中所含铁的质量,由此计算该生铁样品中碳的质量分数;
(2)由于该反应中稀硫酸恰好反应完而杂质不参与反应,反应后所得溶液为硫酸亚铁溶液,利用反应的化学方程式由生成氢气质量计算出生成硫酸亚铁的质量,利用质量守恒定律计算出反应后所得溶液质量,据此可完成反应后的溶液中溶质的质量分数的计算.
(2)由于该反应中稀硫酸恰好反应完而杂质不参与反应,反应后所得溶液为硫酸亚铁溶液,利用反应的化学方程式由生成氢气质量计算出生成硫酸亚铁的质量,利用质量守恒定律计算出反应后所得溶液质量,据此可完成反应后的溶液中溶质的质量分数的计算.
解答:解:产生氢气的质量是:5.8g+30g+50g-85.6g=0.2g
设生铁样品中铁的质量为x,生成FeSO4的质量为y
Fe+H2SO4═FeSO4+H2↑
56 152 2
x y 0.2g
=
x=5.6g
=
y=15.2g
(1)生铁样品中碳的质量分数=
×100%≈3.5%,属于生铁
(2)反应后溶液中溶质的质量分数=
×100%=27.4%
答案:
(1)该铁合金属于生铁
(2)反应后的溶液中溶质的质量分数为27.4%
设生铁样品中铁的质量为x,生成FeSO4的质量为y
Fe+H2SO4═FeSO4+H2↑
56 152 2
x y 0.2g
| 56 |
| 2 |
| x |
| 0.2g |
x=5.6g
| 152 |
| 2 |
| y |
| 0.2g |
y=15.2g
(1)生铁样品中碳的质量分数=
| 5.8g-5.6g |
| 5.8g |
(2)反应后溶液中溶质的质量分数=
| 15.2g |
| 5.6g+50g-0.2g |
答案:
(1)该铁合金属于生铁
(2)反应后的溶液中溶质的质量分数为27.4%
点评:反应的化学方程式可表示反应中各物质的质量关系,由反应中某物质的质量可计算该反应中其它物质的质量.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
下列结构示意图表示离子的是( )
A、 |
B、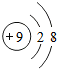 |
C、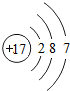 |
D、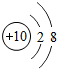 |
某化学兴趣活动小组在准备实验时,甲同学配制了Na2SO4、K2CO3、BaCl2、稀盐酸四种溶液,但没有及时贴标签.乙同学在使用时为区分四种无色溶液,将溶液分别编号为①、②、③、④并进行如下所示实验:
(1)①+②→产生白色沉淀 (2)①+③→有气泡产生 (3)②+④→产生白色沉淀
由此推断①、②、③、④依次是( )
(1)①+②→产生白色沉淀 (2)①+③→有气泡产生 (3)②+④→产生白色沉淀
由此推断①、②、③、④依次是( )
| A、稀盐酸、Na2SO4溶液、K2CO3溶液、BaCl2溶液 |
| B、K2CO3溶液、BaCl2溶液、稀盐酸、Na2SO4溶液 |
| C、BaCl2溶液、K2CO3溶液、Na2SO4溶液、稀盐酸 |
| D、Na2SO4溶液、BaCl2溶液、K2CO3溶液、稀盐酸 |
日常生活中的下列做法属于化学变化的是( )
| A、把煤粉制成蜂窝煤 |
| B、用食醋去除水垢 |
| C、金刚石作装饰品 |
| D、铜丝做导线 |
设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A、2.4g金属镁所含电子数目为0.2 NA |
| B、16g CH4所含原子数目为NA |
| C、17g NH3 所含中子数目为10 NA |
| D、18g水所含分子数目为NA |
 如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算: