题目内容
合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献.合成氨的工艺流程图如图:
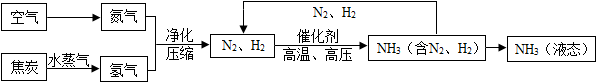
(1)流程中生成的氨气,在农业上是合成 肥(填化肥的种类)的原料.
(2)制取氢气的反应过程为:C+H2O
CO+H2,CO+H2O
CO2+H2.上述两个化学方程式中表现氧化性的物质是 (填化学式).
(3)原料中N2、H2中常含有CO2和水蒸气,反应前要净化.净化过程中所用两种试剂的先后顺序为 .
(4)写出N2、H2反应生成NH3的化学方程式 .
(5)该流程中产生可循环使用的物质是 .

(1)流程中生成的氨气,在农业上是合成
(2)制取氢气的反应过程为:C+H2O
| ||
| ||
(3)原料中N2、H2中常含有CO2和水蒸气,反应前要净化.净化过程中所用两种试剂的先后顺序为
(4)写出N2、H2反应生成NH3的化学方程式
(5)该流程中产生可循环使用的物质是
考点:物质的相互转化和制备,气体的净化(除杂),常见化肥的种类和作用,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)根据质量守恒定律的元素守恒进行回答;
(2)根据题目给出的信息可知:水在上述两个化学方程式中,提供氧元素,表现为氧化性;
(3)杂质CO2和水蒸气,分别用碱溶液和浓硫酸除去,要先除杂质再干燥;
(4)N2、H2在高温高压的条件下反应生成NH3,配平即可;
(5)由图可知:流程中可循环利用的物质.
(2)根据题目给出的信息可知:水在上述两个化学方程式中,提供氧元素,表现为氧化性;
(3)杂质CO2和水蒸气,分别用碱溶液和浓硫酸除去,要先除杂质再干燥;
(4)N2、H2在高温高压的条件下反应生成NH3,配平即可;
(5)由图可知:流程中可循环利用的物质.
解答:解:
(1)根据质量守恒定律的元素守恒,可知:流程中生成的氨气,在农业上是合成氮肥的原料;
(2)水在上述两个化学方程式中,提供氧元素,表现为氧化性;故答案为:H2O
(3)杂质CO2和水蒸气,分别用碱溶液和浓硫酸除去,要先除杂质再干燥;故答案为:先把原料气通过NaOH溶液(或石灰水等碱液)除掉二氧化碳,再通过浓硫酸(或碱石灰等干燥剂)除掉水分;
(4)氮气和氢气在有催化剂和高温高压的条件下生成氨气,故答案为:3H2+N2
2NH3;
(5)由图可知:上述流程中可循环利用的物质是N2、H2;
故答案为:
(1)氮; (2)H2O; (3)先把原料气通过NaOH溶液(或石灰水等碱液)除掉二氧化碳,再通过浓硫酸(或碱石灰等干燥剂)除掉水分;
(4)3H2+N2
2NH3;(5)N2、H2
(1)根据质量守恒定律的元素守恒,可知:流程中生成的氨气,在农业上是合成氮肥的原料;
(2)水在上述两个化学方程式中,提供氧元素,表现为氧化性;故答案为:H2O
(3)杂质CO2和水蒸气,分别用碱溶液和浓硫酸除去,要先除杂质再干燥;故答案为:先把原料气通过NaOH溶液(或石灰水等碱液)除掉二氧化碳,再通过浓硫酸(或碱石灰等干燥剂)除掉水分;
(4)氮气和氢气在有催化剂和高温高压的条件下生成氨气,故答案为:3H2+N2
| ||
| 高温高压 |
(5)由图可知:上述流程中可循环利用的物质是N2、H2;
故答案为:
(1)氮; (2)H2O; (3)先把原料气通过NaOH溶液(或石灰水等碱液)除掉二氧化碳,再通过浓硫酸(或碱石灰等干燥剂)除掉水分;
(4)3H2+N2
| ||
| 高温高压 |
点评:本考点属于实验题中的物质的制备题,综合性比较强,需要掌握酸碱盐的性质,还要掌握相互之间的反应规律和反应的条件.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
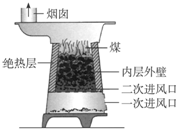 如图是二次进风煤炉示意图(煤的主要成分是碳)
如图是二次进风煤炉示意图(煤的主要成分是碳)