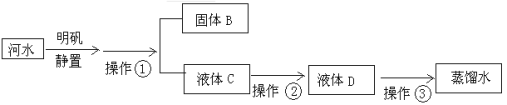
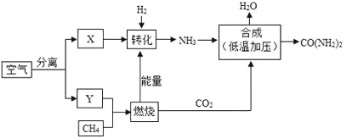
题目内容
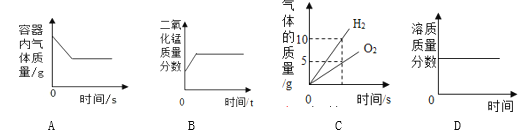
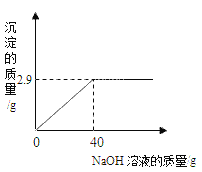
【题目】取30g硫酸镁溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为_______ g.
(2)计算MgSO4溶液中溶质的质量分数_______(写出计算过程)。
【答案】10g 20%
【解析】
(1)根据溶质质量分数的计算公式计算;
(2)根据反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系图,判断恰好完全反应即曲线折点所加氢氧化钠溶液的质量,并根据反应的化学方程式,由氢氧化钠质量计算MgSO4的质量,再计算出MgSO4溶液中溶质的质量分数。
(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为:100g×10%=10g;
(2)由反应的曲线可知,当加入40g氢氧化钠溶液时恰好完全反应。设MgSO4溶液中溶质的质量为x。
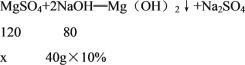
![]()
x=6g
MgSO4溶液中溶质的质量分数为:![]() =20%
=20%
答:(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为10g;(2)MgSO4溶液中溶质的质量分数为20%。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目