题目内容
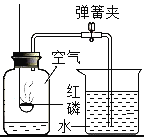
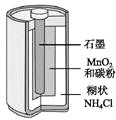
【题目】小刚收集到一瓶浑浊的太湖水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如下所示。请回答以下问题。
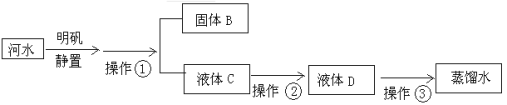
(1)操作①的名称是________,此操作中用到的玻璃仪器有玻璃棒,烧杯和________。
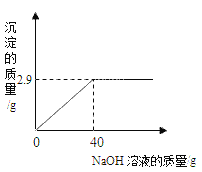
(2)操作②向滤液C中加入______________,利用其吸附作用除去水样中的颜色和异味。此过程主要发生_______变化(填“物理”、“化学”)。
(3)小刚取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多泡沫出现,此现象说明液体D是_______(填“硬水”、“软水”)。
(4)消毒剂高铁酸钠(化学式为Na2FeO4)集氧化、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化。高铁酸钠中铁元素的化合价为_______。
(5)爱护水资源是每个公民的责任和义务,下列行为属于节约用水的是___(填字母).
A.农业和园林浇灌改大水漫灌为喷灌 B.洗菜的水用来浇花
C.用自来水不断为西瓜冲水降温 D.用工业废水浇地.
【答案】过滤、 漏斗 活性炭 物理 软水 +6 AB
【解析】
(1)操作①是将固液分离的过程,故名称是过滤;过滤中用到的玻璃仪器有玻璃棒,烧杯和漏斗。
(2)活性炭具有吸附性,可以吸附色素和异味,该过程中没有新物质生成,故是物理变化。
(3)向水中加入肥皂水,泡沫较多的是软水。
(4)Na2FeO4中钠元素的化合价为+1价,氧元素的化合价为-2价,设铁元素的化合价是x,根据化合价的代数和为0,+1×2+x+(-2)×4=0,x=+6价。
(5)A.农业和园林浇灌改大水漫灌为喷灌可以节约用水,故正确;
B.洗菜的水用来浇花起到一水多用的作用,可以节约用水,故正确;
C.用自来水不断为西瓜冲水降温会造成水资源的浪费,故错误;
D.用工业废水不能浇地,故错误。故选AB。

 全优点练单元计划系列答案
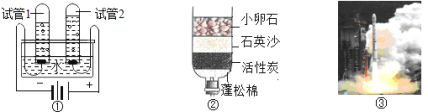
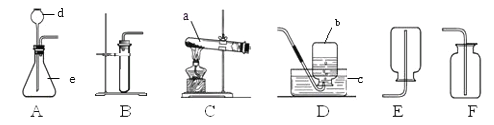
全优点练单元计划系列答案【题目】为进一步认识氧气,老师请你一起参加实验室制取氧气的实践和研究。
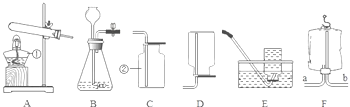
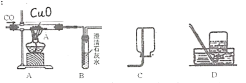
(1)实验室用A制取氧气的化学方程式为_____,收集氧气可选用E装置,理由是____.收集完气体后,测得氧气纯度明显偏低,原因可能是______(填序号).
A.高锰酸钾中混入了二氧化锰 B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水 D.未见气泡连续均匀冒出时就开始收集
(2)现准备收集氧气供铁丝、硫燃烧的实验使用,选择__(填装置序号)装置收集氧气便于直接做实验。
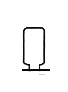
(3)某同学利用空塑料输液袋(如图F)收集氧气,验满氧气时,把带火星的木条放在玻璃管__(填“a”或“b”)端,若复燃则收集满了.
(4)乙炔是一种微溶于水的气体,密度与空气接近,实验室常用块状电石和水在常温下反应制取乙炔.制取乙炔的发生装置为___(填装置序号).
(5)拓展延伸:小亮同学在制取氧气的实验过程中,不小心把硫酸铜溶液滴加到了盛有5%的过氧化氢溶液中,立即产生大量气泡,于是引起了小亮同学的探究兴趣.
(提出问题)是哪种粒子能使过氧化氢分解的速率加快呢?
(查阅资料)稀硫酸中含有的粒子(H2O、H +、SO42-); CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小明同学作了以下分析和设计。
(猜想与假设)
Ⅰ、小亮同学认为不可能是H2O,理由是____;
Ⅱ、可能是SO42-;Ⅲ、可能是Cu2+.
(实验验证)
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5mL5%过氧化氢溶液,然后加入2﹣3滴稀硫酸 | 溶液几乎没有气泡放出 | ___不能使过氧化氢分解速率加快。 |
b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2﹣3滴CuSO4溶液 | 溶液中有大量气泡放出 |
结论;实验证明,使过氧化氢分解速率加快的是_________。
(反思与交流)
Ⅰ、如果要证明硫酸铜是催化剂,还需要证明______。
Ⅱ、已知氧化铜也能做该反应的催化剂,现在把8克硫酸铜改为氧化铜,要使其铜元素质量相等,则需要氧化铜的质量是多少______?请列式计算。