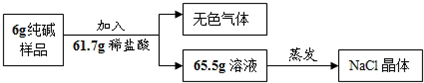
题目内容
某校化学研究小组的同学通过实验测定某石灰石样品中碳酸钙的质量分数.取10g样品,分四次加入稀盐酸,测得每次生成二氧化碳的质量如表所示(杂质不与盐酸反应)
(1)碳酸钙中,钙、碳、氧元素的质量比为______;
(2)表中m=______;10g样品分四次加入稀盐酸后,共产生CO2的质量为______.
(3)试计算该石灰石样品中碳酸钙的质量分数.
| 实验 | 1 | 2 | 3 | 4 |
| 加入稀盐酸/mL | 15 | 15 | 15 | 15 |
| 二氧化碳质量/g | 1.50 | 1.50 | 0.52 | m |
(2)表中m=______;10g样品分四次加入稀盐酸后,共产生CO2的质量为______.
(3)试计算该石灰石样品中碳酸钙的质量分数.
(1)碳酸钙中,钙、碳、氧元素的质量比=40:12:(16×3)=10:3:12;故填:10:3:12;
(2)根据记录数据可发现,第二次实验中加入盐酸还有二氧化碳放出,说明第一次实验验中盐酸全部反应,放出二氧化碳的质量为1.50g,第三次实验中只放出0.52g二氧化碳,说明盐酸有剩余,所以在第三次实验中碳酸钙已经反应完,所以第四次再加入盐酸不会有二氧化碳气体放出,所以m的值为0,共产生CO2的质量=1.50g+1.50g+0.52g=3.52g;故填:0;3.52g;
(3)设石灰石中CaCO3的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
x3.52g
=
x=8g
石灰石样品中CaCO3的质量分数=
×100%=80%
答:石灰石样品中CaCO3的质量分数为80%.
(2)根据记录数据可发现,第二次实验中加入盐酸还有二氧化碳放出,说明第一次实验验中盐酸全部反应,放出二氧化碳的质量为1.50g,第三次实验中只放出0.52g二氧化碳,说明盐酸有剩余,所以在第三次实验中碳酸钙已经反应完,所以第四次再加入盐酸不会有二氧化碳气体放出,所以m的值为0,共产生CO2的质量=1.50g+1.50g+0.52g=3.52g;故填:0;3.52g;
(3)设石灰石中CaCO3的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
x3.52g
| 100 |
| x |
| 44 |
| 3.52g |
x=8g
石灰石样品中CaCO3的质量分数=
| 8g |
| 10g |
答:石灰石样品中CaCO3的质量分数为80%.

练习册系列答案
相关题目