题目内容
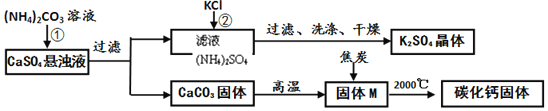
【题目】某硫酸厂产生的烧渣(主要含 Fe2O3、Fe3O4、FeO,还有少量难溶于水和酸的 SiO2)可用于制备 FeCO3,其流程如下:
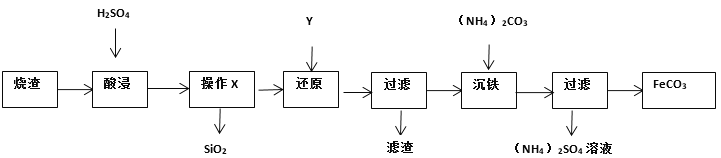
回答下列有关问题:
(1)烧渣酸浸前需粉碎,其目的是_____;
(2)操作 X 的名称为_____该操作使用到的玻璃仪器有_____(任写一种);
(3)“还原”是通过加入过量的 Y 使 Fe2(SO4)3转化为 FeSO4,已知铜和铁都可使 Fe2(SO4)3转化为 FeSO4,本流程中 Y 最好选择_____ ;
(4)“沉铁”时发生反应的化学方程式为_____。
【答案】增大反应物的接触面积,使反应充分进行 过滤 玻璃棒或烧杯或漏斗 Fe (NH4)2CO3+FeSO4=FeCO3↓+(NH4)2SO4
【解析】
(1)根据影响反应速率的因素进行分析;
(2)根据过滤可以将不溶性固体从溶液中分离出来,过滤需要的玻璃仪器进行分析;
(3)根据除杂过程中不能引入新的杂质进行分析;
(4)根据碳酸铵和硫酸亚铁反应生成碳酸亚铁和硫酸铵进行分析。
(1)烧渣酸浸前需粉碎,其目的是:增大反应物的接触面积,使反应充分进行;
(2)“操作X”是固体和液体分离的操作,为过滤,在实验室进行该操作用到的玻璃仪器有:烧杯、玻璃棒和 漏斗;
(3)铜和铁都可使 Fe2(SO4)3转化为FeSO4,但铜会引入杂质,所以流程中Y最好选择铁;
(4)碳酸铵和硫酸亚铁反应生成碳酸亚铁和硫酸铵,化学方程式为:(NH4)2CO3+FeSO4=FeCO3↓+(NH4)2SO4

【题目】某研究性小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的稀盐酸加入氢氧化钙溶液一会儿后,发现忘记滴加指示剂,因此,他们停止滴加氢氧化钙溶液,并对烧杯内溶液中的溶质成分进行探究
(提出问题)该烧杯内溶液中的溶质是什么?
(提出猜想)猜想①:可能是CaCl2和Ca(OH)2;猜想②:_____猜想③可能是CaCl2和HCl
(查阅资料)氯化钙溶液呈中性。
(实验探究)
实验步骤 | 实验现象 | 结论 |
取少量烧杯内溶液于试管中,滴入几滴酚酞溶液 | _____ | 猜想①不成立 |
取少量烧杯内溶液于试管 中逐滴加入Na2CO3溶液 | _____ | 猜想②成立 |
_____ | 猜想③成立 |
(反思)(1)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑_____。
(2)若猜想③正确,要处理烧杯内溶液使其溶质只含有CaCl2,应向烧杯中加入过量的_____(化学式)。
(3)验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质或者方法单独使用也能完成该实验_____?
A.pH试纸 B.镁条 C.检查导电性 D.铜片
(拓展延伸)(注意:若答对(拓展延伸)奖励4分,化学试卷总分不超过60分。)
(1)在进行酸碱中和反应实验的过程中,研究性小组取一定量的稀盐酸,逐滴匀速滴加氢氧化钙溶液,用pH和温度电子传感器实时获得的pH、温度曲线(如图),由图你得到的认识,
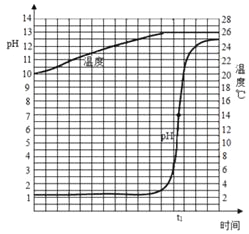
请写出两条①_____②_____。
(2)微粒观是化学基本观念的重要组成部分,也是化学基本观念中最基础的部分,从微观视角认识和考察物质世界是研究化学应掌握的重要思维方法,试从微观角度分析酸碱中和反应的实质是_____。由中和反应实质可以知道部分离子在水溶液中不能共存,请再写出一组不能共存的离子_____。