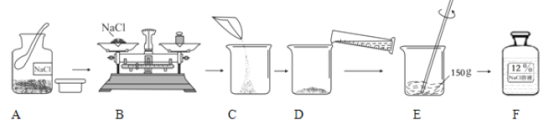
题目内容
【题目】有盐酸和氯化钙的混合溶液200g,向混合溶液中逐滴加入20%的Na2CO3溶液,生成沉淀的质量与加入Na2CO3溶液的质量关系如图。若CaCl2在原混合液中的质量分数为11.1%。求:
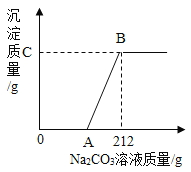
(1)A点表示的质量。
(2)反应进行到B点时溶液的溶质质量分数。
【答案】(1)106g(2)12.21%
【解析】
向盐酸和氯化钙的混合溶液中逐滴加入20%的Na2CO3溶液,Na2CO3溶液先与盐酸反应生成氯化钠、水和二氧化碳,再与氯化钙溶液反应生成碳酸钙和氯化钠。
(1)200g混合物溶液中含氯化钙的质量=200g×11.1%=22.2g;
设:22.2g氯化钙恰好完全反应时需要碳酸钠溶液的质量为x,生成沉淀的质量为y,氯化钠的质量为z。
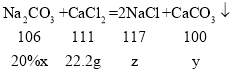
![]() x=106g;
x=106g;
![]() y=20g;
y=20g;
![]() z=23.4g;A点表示的质量=212g-106g=106g;
z=23.4g;A点表示的质量=212g-106g=106g;
(2)设:盐酸和碳酸钠反应生成二氧化碳的质量为m,氯化钠的质量为n。
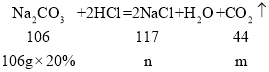
![]() m=8.8g;
m=8.8g;
![]() n=23.4g
n=23.4g
反应进行到B点时溶液的溶质质量分数=![]()

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如下表所示:
物 质 | A | B | C | D |
反应前质量/g | 19.7 | 8.7 | 21.6 | 0.4 |
反应后质量/g | 待测 | 17.4 | 0 | 3.5 |
下列说法正确的是
A.反应后密闭容器中A的质量为19.7g
B.物质C一定是化合物,该反应可能是复分解反应也可能是置换反应
C.反应过程中,物质B和物质D变化的质量比为87∶35
D.若A与C的相对分子质量之比为196∶216,则反应中A和C的化学计量数之比为1∶2
【题目】化工厂用废硫酸制备K2SO4的流程如下:
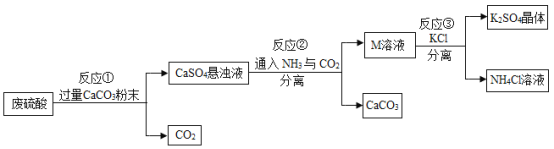
(1)生产上将CaCO3研成粉末的目的是_______欲达此目的,还可采用的方法是__________ (任写一条)
(2)上述流程中,还可循环使用的物质是___(填写化学式).
(3)写出反应①中主要的化学方程式_______
(4)反应③中相关物质的溶解度如下表所示,反应③在常温下可实现的原因是______
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(5)洗涤反应③所得晶体最适宜的试剂是___________ (填序号)
A H2O B 饱和K2SO4溶液 C 二者均可
(6)检验K2SO4晶体是否洗涤干净的方法是 ____________