题目内容
【题目】潍坊海水资源丰富,从海水得到的粗盐往往含有可溶性杂质(MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活。实验室模拟工业粗盐提纯的流程如图,请回答:
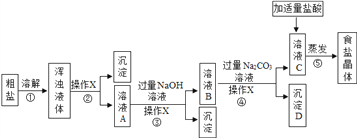
(1)操作X的名称是_____,该操作中用到的玻璃仪器有烧杯、玻璃棒和______。
(2)加适量盐酸的目的是____________________________________________。
(3)生成沉淀D的化学方程式为_____________________________ 。
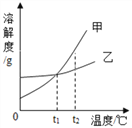
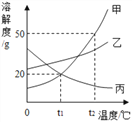
(4)下图为氯化钠、碳酸钠在水中的溶解度曲线。 请回答下列问题。
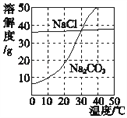
①30℃时,将等质量的两种物质的饱和溶液同时降温至10℃,晶体析出后所得氯化钠溶液的溶质质量分数___(填“>”“<”或“=”)碳酸钠溶液的溶质质量分数。
②在20℃时,各取NaCl、Na2CO3固体30g,分别加入100g水,充分溶解后达到饱和状态的物质是_____。
【答案】 过滤 漏斗 除去过量的碳酸钠和氢氧化钠 CaCl2+Na2CO3=CaCO3↓+2NaCl > Na2CO3
【解析】(1)根据过滤操作除去的是不溶性固体杂质以及使用的玻璃仪器解答;(2)根据除去除杂过程中所加过量的氢氧化钠和碳酸钠解答;(3)根据碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠解答;(4)①根据溶解度曲线分析解答;②根据20℃时NaCl、Na2CO3的溶解度分析解答。(1)操作X的名称是过滤,该操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗;(2)加适量盐酸的目的是除去过量的碳酸钠和氢氧化钠;(3)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl;(4)①由溶解度曲线可知,氯化钠的溶解度受温度的影响变化较小,碳酸钠的溶解度受温度的影响变化较大,30℃时氯化钠和碳酸钠的溶解度相等,10℃时氯化钠的溶解度大于碳酸钠的溶解度。故0℃时,将等质量的两种物质的饱和溶液同时降温至10℃,晶体析出后所得氯化钠溶液的溶质质量分数>碳酸钠溶液的溶质质量分数;②由溶解度曲线可知,20℃时,氯化钠的溶解度大于30g,碳酸钠的溶解度小于30g。故在20℃时,各取NaCl、Na2CO3固体30g,分别加入100g水,充分溶解后达到饱和状态的物质是Na2CO3。

【题目】我市石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品10.0g于烧杯中,将100g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下.
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量/g | 20 | 20 | 20 | 20 | 20 |
剩余固体质量/g | 8.0 | 6.0 | 4.0 | 2.5 | X |
请计算:(1)X的值为__________.
(2)该石灰石样品中碳酸钙的质量分数为_____________
(3)所用稀盐酸溶质的质量分数为________.(写出计算过程)