��Ŀ����
����Ŀ����Һ���ڶ�ֲ�������������������������ѧ�о������������塣
��1��ij��ѧʵ��С��������100g������������Ϊ20%������������Һ������ͼ��ʾ������в�����
�ټ��㣺��ҪNaOH����_____g��ˮ_____mL��ˮ���ܶ�ԼΪ1.0g/mL����
�ڳ���������ȡ������ͼ��������һ������_____��
���ܽ⣺����Ͳ��ȡ�õ�ˮ����ʢ��NaOH���ձ��У��ò���������������ȫ���ܽ⼴�ɡ�
�ܴ�ţ������ƺõ���Һװ���Լ�ƿ�У��Ǻ�ƿ�������ϱ�ǩ��
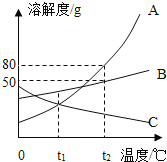
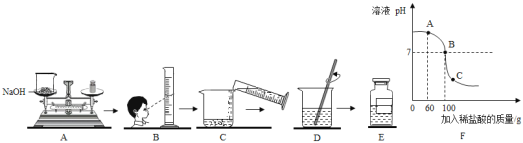
��2��С���Ա�ڷ�˼�뽻��ʱ����ʶ��ʵ������еĴ��������Ӱ������������Һ������������������ˣ���Ҫ����������������Һ���������������������²ⶨ�����±�ǩ����ʵ�鷽�����£�
ȡ������������������Һ50g����ε���������������Ϊ7.3%��ϡ���ᡣ��ʵ�����������ϡ�������������ҺpH�ı仯������ͼF��ʾ��
�ٵ�����ϡ����60gʱ����ͼ��A�㣩����ʱ������Һ�е�����Ϊ_____��д��ѧʽ����
�ڵ�����ϡ����100gʱ����ͼ��B�㣩����ҺpHǡ��Ϊ7���Ը��ݻ�ѧ����ʽ���㣺��ʵ����������������Һ��������������ʵ��Ϊ______ �������Լ�ƿ��ǩ�ϵ�ʵ��Ũ����д�������ȷ��0.1%��
���𰸡�20 80 B��������Ͳ��������û���밼Һ����ʹ���ƽ�� NaOH��NaCl 16.0%
��������
��1������100g������������Ϊ20%������������Һʱ��Ҫ�������Ƶ�������100g��20%��20g����Ҫˮ��������100g��20g��80g��ˮ�����Ϊ�� ![]() ��80ml��
��80ml��
��ͼʾ�����֪B�еĶ���������������Ҫ������B��������Ͳ��������û���밼Һ����ʹ���ƽ����
��2����A���ʾ�μ�60gϡ����ʱ��������û����ȫ��Ӧ������Һ�е�����Ϊ��NaOH��NaCl��
�ڵ�����ϡ����100gʱ����ͼ��B�㣩����ҺpHǡ��Ϊ7����ʱ�������������ǡ����ȫ��Ӧ����Ӧ��HCl������100g��7.3%��7.3g
��NaOH������Ϊx����
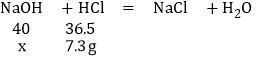
![]()
x��8.0 g
������������Һ��������������Ϊ��![]()
��������NaOH��ҺŨ��Ϊ16.0%��
�ʴ�Ϊ����1����20�� 80����B��������Ͳ��������û���밼Һ����ʹ���ƽ����
��2����NaOH��NaCl����������NaOH��ҺŨ��Ϊ16.0%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ȤС���ͬѧ�����ṩ���Լ���ϡ���ᡢ����ʯ��ˮ���Ȼ�����Һ������ͭ��Һ����ɫʯ����Һ��̽������ε����ʣ�С��ͬѧ���Ȼ�����Һ���뵽ϡ������û�й۲쵽���������������Һ����һ��ʱ�������صõ���ɫ���д̼�����ζ������.
��������⣩�̼�����ζ��������ʲô��
����������裩����1.�����Ƕ���������2.�������Ȼ��⣻����3.�����ǰ���
������ۺ���Ϊ����3��������������_____.
���������ϣ�SO2��CO2�Ļ�ѧ�������ƶ���ʹ����ʯ��ˮ����ǣ�д������������������Ʒ�Ӧ�Ļ�ѧ����ʽ_____��
��ʵ��̽������ͼ��ʾ��С�Ͻ�����������ͨ����ɫʯ����Һ�У��۲쵽_____������Ϊ����2��ȷ.
��������Ľ���С����ΪС�ϵĽ��۲���ѧ�������������ṩ���Լ�ͨ��ʵ��ȷ���˲���2��ȷ.
ʵ����� | ʵ������ |
��ͼ��ʾ��������������_____ | ���������� |
Ϊ��һ��֤��������ȷ�������ֽ�������ͨ��_____��Һ�У��۲쵽��Ԥ�ڵİ�ɫ����.
�����ۣ������Ȼ��ƺ�����Ļ������Һ�õ����������Ȼ���.