题目内容
【题目】通过化学课程的学习,我们收获很多。
收获一:通过化学学习你已经知道:
(1)空气中的三大污染性气体有SO2、____和_____;稀有气体包括He、______Ar等。
(2)木炭在氧气中充分燃烧的化学方程式为:_____________。
(3)实验室加热约4mL液体,你选择的仪器有________。

收获二:我们学会了从微观的角度认识世界。试从分子、原子的角度
(1)“加压时,6000L氧气可装入容积为40L的钢瓶中”说明__________(填分子的性质)。
(2)小明学习了分子的性质后做了如下实验:
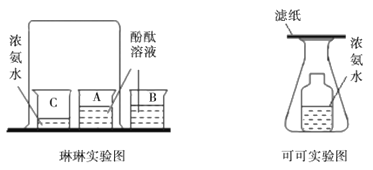
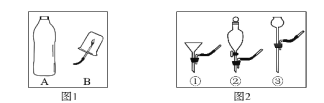
①教材实验(如图1):该实验可以观察到的实验现象是______,实验结论是_______。
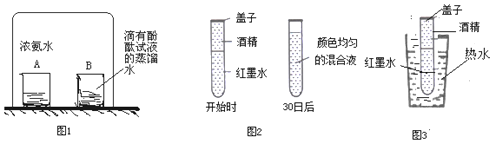
②改进实验:先在一支试管中装一半红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察,现象如图2所示.小明做的实验还可以说明的分子性质是:_____ 。
③如果继续完成图3实验操作,可以得出的结论是_______
(3)电解水的化学方程式为:________ ;有人说“这个实验产生了氢气和氧气,所以水具有氢气和氧气的化学性质”,你认为这个说法不正确的理由__________(用分子的观点解释)
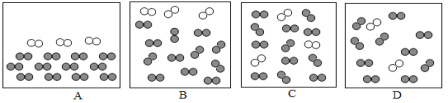
(4)用“![]() ”表示氧原子,“
”表示氧原子,“![]() ”表示氮原子。用微观示意图表示空气中的主要成分,下图中最合理的是_______(填序号)。(资料:在同温同压下,气体的体积之比等于分子个数之比)
”表示氮原子。用微观示意图表示空气中的主要成分,下图中最合理的是_______(填序号)。(资料:在同温同压下,气体的体积之比等于分子个数之比)
【答案】NO2 CO Ne C+O2![]() CO2 ②③⑤ 压强越大,分子之间的间隔越小 烧杯B中的溶液变成红色 分子在不断运动 分子之间有间隔 温度越高,分子运动越剧烈 2H2O通电2H2↑ + O2↑ 分子不同,化学性质不同 C
CO2 ②③⑤ 压强越大,分子之间的间隔越小 烧杯B中的溶液变成红色 分子在不断运动 分子之间有间隔 温度越高,分子运动越剧烈 2H2O通电2H2↑ + O2↑ 分子不同,化学性质不同 C
【解析】
收获一:(1)NO2在空气易形成硝酸型酸雨,CO有毒;稀有气体包括He、Ne 、Ar等。空气中的三大污染性气体有SO2、NO2 和CO;稀有气体包括He、Ne 、Ar等;
(2)碳与氧气在点燃的条件下反应生成二氧化碳;木炭在氧气中充分燃烧的化学方程式为:C+O2![]() CO2;
CO2;
(3)加热约4mL液体,属于较少体积的液体,应用试管,用试管加热不需要用石棉网,需用酒精灯、试管夹;故选②③⑤;
收获二:(1)由于分子间有间隔,在加压时间隔变小,加压时,6000L氧气可装入容积为40L的钢瓶中,说明压强越大,分子之间的间隔越小;
(2)①浓氨水具有挥发性,挥发出来的氨气分子不断地运动,运动到酚酞试液中,酚酞试液变成红色。该实验可以观察到的实验现象是酚酞试液变成红色,实验结论是分子不断地运动;
②先在一支试管中装一半红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察,现象是混合后液体的体积普小,小明做的实验还可以说明的分子性质是:分子存在着间隔;
③图3是在热水中进行实验,加入热水后溶液变红的更快,这样的设计是想研究探究温度对分子运动的影响(是否温度越高,分子运动越快),可以得出的结论是温度越高,分子运动越快;
(3)电解水产生了氢气和氧气,电解水的化学方程式为:2H2O![]() 2H2↑ + O2↑;水分解生成了氢气和氧气,但水不具有氢气和氧气的性质,原因是分子是保持物质化学性质的最小粒子,水分子只能保持水的化学性质。即:分子不同,化学性质不同,所以水不具有氢气和氧气的化学性质。
2H2↑ + O2↑;水分解生成了氢气和氧气,但水不具有氢气和氧气的性质,原因是分子是保持物质化学性质的最小粒子,水分子只能保持水的化学性质。即:分子不同,化学性质不同,所以水不具有氢气和氧气的化学性质。
(4)氧气约占空气体积的1/5,氮气约占空气体积的4/5,图C中氮气分子和氧气分子4:1,且混合均匀,故可表示空气微观模型的是C;

 阅读快车系列答案
阅读快车系列答案【题目】为进一步认识氧气,老师请你一起参加实验室制取氧气的实践和研究。
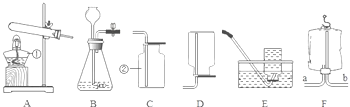
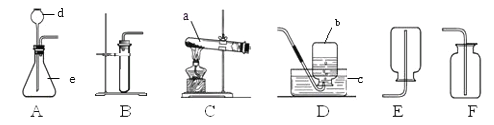
(1)实验室用A制取氧气的化学方程式为_____,收集氧气可选用E装置,理由是____.收集完气体后,测得氧气纯度明显偏低,原因可能是______(填序号).
A.高锰酸钾中混入了二氧化锰 B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水 D.未见气泡连续均匀冒出时就开始收集
(2)现准备收集氧气供铁丝、硫燃烧的实验使用,选择__(填装置序号)装置收集氧气便于直接做实验。
(3)某同学利用空塑料输液袋(如图F)收集氧气,验满氧气时,把带火星的木条放在玻璃管__(填“a”或“b”)端,若复燃则收集满了.
(4)乙炔是一种微溶于水的气体,密度与空气接近,实验室常用块状电石和水在常温下反应制取乙炔.制取乙炔的发生装置为___(填装置序号).
(5)拓展延伸:小亮同学在制取氧气的实验过程中,不小心把硫酸铜溶液滴加到了盛有5%的过氧化氢溶液中,立即产生大量气泡,于是引起了小亮同学的探究兴趣.
(提出问题)是哪种粒子能使过氧化氢分解的速率加快呢?
(查阅资料)稀硫酸中含有的粒子(H2O、H +、SO42-); CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小明同学作了以下分析和设计。
(猜想与假设)
Ⅰ、小亮同学认为不可能是H2O,理由是____;
Ⅱ、可能是SO42-;Ⅲ、可能是Cu2+.
(实验验证)
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5mL5%过氧化氢溶液,然后加入2﹣3滴稀硫酸 | 溶液几乎没有气泡放出 | ___不能使过氧化氢分解速率加快。 |
b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2﹣3滴CuSO4溶液 | 溶液中有大量气泡放出 |
结论;实验证明,使过氧化氢分解速率加快的是_________。
(反思与交流)
Ⅰ、如果要证明硫酸铜是催化剂,还需要证明______。
Ⅱ、已知氧化铜也能做该反应的催化剂,现在把8克硫酸铜改为氧化铜,要使其铜元素质量相等,则需要氧化铜的质量是多少______?请列式计算。