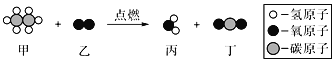
��Ŀ����
����Ŀ�����۵ĽǶ��˽����ʼ���仯�������ڸ��õ���ʶ������ɺͱ仯�ı��ʡ�
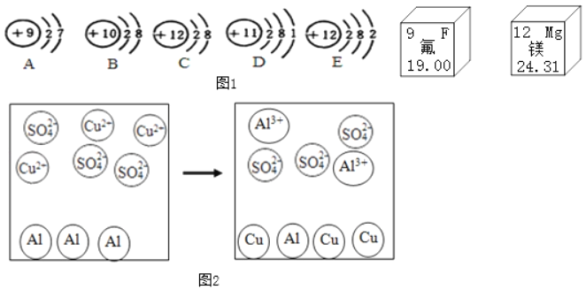
��1����֪A�����ԭ������Ϊ19������A����������Ϊ_____��A��E�γɻ�����Ļ�ѧʽΪ_____��
��2������A��B��C��D��E�У�����ͬһ��Ԫ�ص���_____������ţ������ڵڶ����ڵ�Ԫ�ع�_____�֡�
��3��D��E��ѧ���ʲ�ͬ��ԭ����_____��
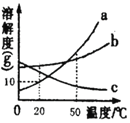
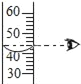
��4��ͼ2ΪAl��CuSO4��Һ��Ӧ��ʾ��ͼ��
�ش��������⣺
�ٸ÷�Ӧ��Al��Cu2+�ĸ�����Ϊ_____��
�ڷ�Ӧ��ʧȥ���ӵ�������_____��
���ɷ�Ӧ��֪�����Ļ����ԣ�Al_____Cu����������������������
�ܸ÷�Ӧ�л��ϼ�û�иı��Ԫ�ػ����_____��
A ��Ԫ�� B ͭԪ�� C �����
���𰸡�10�� MgF2�� CE�� 2�� ������������ͬ 2��3�� ��ԭ�ӣ� ���� C��
��������
��1����֪A�����ԭ������Ϊ19������������Ϊ9���������ԭ��������������+����������������A����������Ϊ19��9��10��AΪF�������ϼ�Ϊ��1�ۣ���EΪþԪ�أ�������������ӣ����Ի��ϼ�һ��Ϊ+2�ۣ�����A��E�γɻ�����Ļ�ѧʽΪ MgF2��
��2������A��B��C��D��E�У�Ԫ���Ǿ�����ͬ���������˵������ͬһ��ԭ�ӵ��ܳƣ�������������ͬһ��Ԫ�ص��� CE��ԭ�ӵĵ��Ӳ������������������ڵڶ����ڵ���ԭ�ӵĵ��Ӳ���Ϊ����ģ��������ڵڶ����ڵ�Ԫ����AB����2�֡�
��3��Ԫ�ص�������Ҫ���������ĵ����������ģ�D��E��ѧ���ʲ�ͬ��ԭ����������������ͬ��
��4������ͼʾ�����ı仯��֪���÷�Ӧ��Al��Cu2+�ĸ�����Ϊ2��3��
�ڷ�Ӧ����ԭ�ӱ���������ӣ�ʧȥ���ӵ���������ԭ�ӡ�
���ɷ�Ӧ��֪�����ܽ�ͭ������Һ���û������������Ļ����ԣ�Al��Cu��
���ɻ��ϼ�ԭ���֪���÷�Ӧ�л��ϼ�û�иı�����������