题目内容
有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。现取8g石灰石样品与足量的50g稀盐酸完全反应后,称得容器内的物质总质量为55.36g。
试回答下列问题:
(1)反应后容器内的物质有 。
(2)反应产生二氧化碳的质量为 。
(3)该石灰石样品中碳酸钙的质量分数是多少?
【答案】
(1)SiO2、CaCl2、HCl、H2O
(2)2.64g
(3)75%
【解析】
试题分析:(1)石灰石与足量稀盐酸反应,则碳酸钙完全反应,盐酸有剩余;该反应会生成氯化钙和水;石灰石样品中有二氧化硅,SiO2既不溶于水也不与盐酸反应,则二氧化硅也含有;所以反应后容器内的物质有SiO2、CaCl2、HCl、H2O
(2)根据题意,石灰石与稀盐酸反应的化学方程式为:
CaCO3+2HCl = CaCl2+H2O+CO2↑
依据质量守恒定律化学反应前后物质的总质量不变,则减少的质量为反应生成的二氧化碳的质量,即二氧化碳的质量=50g+8g-55.36g =2.64g
(3)利用化学方程式中碳酸钙与二氧化碳的质量比,结合二氧化碳的质量,可求出样品中碳酸钙的质量。
解:设石灰石样品中碳酸钙的质量为x
CaCO3+2HCl = CaCl2+H2O+CO2↑
100 44
x 2.64g
100/44 =x/2.64g
x=6g
石灰石样品中碳酸钙的质量分数为:6g/8g ×100% =75%
答:石灰石样品中碳酸钙的质量分数为75% 。
考点:根据化学反应方程式的计算

练习册系列答案
相关题目
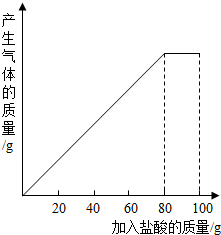 有一种石灰石样品的主要成分是CaCO3.课外小组同学将100g稀盐酸分5次加入到35g石灰石样品中(已知杂质不与盐酸反应也不溶于水),得到如下部分数据和图象.请仔细观察下列表格和图象计算:
有一种石灰石样品的主要成分是CaCO3.课外小组同学将100g稀盐酸分5次加入到35g石灰石样品中(已知杂质不与盐酸反应也不溶于水),得到如下部分数据和图象.请仔细观察下列表格和图象计算:| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(2)石灰石样品中CaCO3质量分数为多少?(结果精确到0.1%)
(3)10%的CaCl2溶液可作为路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰右粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
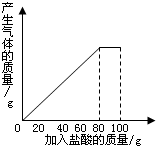 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(1)第2次加入盐酸后,a为
(2)石灰石样品中钙元素、碳元素和氧元素的质量比为多少?(结果用最简整数比表示)
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据;
欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,请计算:这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | 25 | 20 | 15 | 15 |
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不溶于水也不与盐酸反应),得到如下表部分数据.
请计算:
(1)第2次加入盐酸后,a为 g.
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
(4)画出35g石灰石样品中加入盐酸的质量与剩余固体的质量变化关系的示意图(在“答题卡”框图中作图)
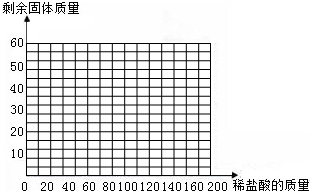
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 | 15 | 15 |
(1)第2次加入盐酸后,a为
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
(4)画出35g石灰石样品中加入盐酸的质量与剩余固体的质量变化关系的示意图(在“答题卡”框图中作图)
